
【题目】钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如下:

已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为
(2)步骤I中检验钛矿废水中加入铁屑是否足量的试剂是 。
(3)操作a是蒸发浓缩、冷却结晶、 。
(4)步骤Ⅲ中发生反应的化学方程式为____________;反应温度一般需控制在35℃以下,其目的是 。
(5)已知![]() s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末得到固体TiO2·nH2O。请结合原理和化学用语解释其原因 。
【答案】 (1)+4(1分)(2)KSCN溶液(2分)(3)过滤(或过滤、洗涤)(1分)
(4)FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+SO2↑;
防止NH4HCO3受热分解,减小Fe2+水解或氧化
(5)没有;向反应容器中补充适量空气(氧气)
(6)溶液中存在水解平衡TiO2++(n+1)H2O![]() TiO2n H2O+2H+,加入的Na2CO3粉末与H+反应,降低了溶液中c(H+),促进水解平衡向生成TiO2n H2O的方向移动
TiO2n H2O+2H+,加入的Na2CO3粉末与H+反应,降低了溶液中c(H+),促进水解平衡向生成TiO2n H2O的方向移动
【解析】
试题分析:(l)TiO2+中氧元素是-2价,则钛的化合价为+4价;
(2)如果铁不足,则溶液中仍然存在铁离子,因此步骤I中检验钛矿废水中加入铁屑是否足量的试剂是KSCN溶液。
(3)操作a是蒸发浓缩、冷却结晶、过滤、洗涤。
(4)步骤Ⅲ中发生的反应是硫酸亚铁和碳酸氢铵反应,反应的化学方程式为FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+SO2↑;铵盐受热易分解,则反应温度一般需控制在35℃以下的目的是防止NH4HCO3受热分解,减小Fe2+水解或氧化。
(5)此时浓度熵=10-6×(10-5.5)2=10-17<8×10-16,因此所得的FeCO3中没有Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是向反应容器中补充适量空气(氧气)。
(6)富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O![]() TiO2n H2O+2H+向生成TiO2n H2O的方向移动,可得到TiO2粗产品。
TiO2n H2O+2H+向生成TiO2n H2O的方向移动,可得到TiO2粗产品。


科目:高中化学 来源: 题型:
【题目】生命中无时无刻不进行着许许多多的化学反应,这些反应要根据环境的变化和身体的需要而灵活控制、自动调节,以维持生命活动的持续,所有这一切都离不开酶。下列有关酶的叙述错误的是( )
A.酶是具有催化功能的蛋白质
B.酶的催化作用具有选择性和专一性
C.高温或紫外线的照射会降低酶的活性
D.酶通常在强酸或强碱的条件下发挥作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序.若以E表示某能级的能量,下列能量大小顺序中正确的是 ( )
A. E(3s)>E(3p)>E(3d) B. E(3s)>E(2s)>E(1s)
C. E(2f)>E(3d)>E(4s) D. E(5s)>E(4s)>E(4f)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,以下说法正确的是( )
A. 氯化氢气体的摩尔质量等于NA个氯气分子和NA个氢气分子的质量之和
B. 常温常压下1 mol NO2气体与水反应生成NA个NO3-离子
C. 121g CCl2F2所含的氯原子数为2NA
D. 62g Na2O溶于水后所得溶液中含有O2-离子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验或实验装置进行的实验中,能达到相应实验目的的是( )

A.装置甲:防止铁钉生锈
B.测定同温同浓度的NaCl和NaF溶液的pH,确定F、Cl两元素的非金属性的强弱
C.装置乙:除去甲烷中混有的乙烯
D. 用Ca(OH)2溶液来鉴别Na2CO3溶液和NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]已知反应![]()
(1)基态Fe原子核外共有 种运动状态不相同的电子;Fe3+的价电子排布图为__________。
(2)NaH的电子式为 ;1mol NaOH含有的d键数目为___________,其中O原子的杂化类型为 ;Fe3+可以和SCN-形成配合物,该反应是典型的可逆反应,说明配位原子配位能力 (填“强”或“弱”)。
(3)上述反应中含Na的化合物晶体类型均为 晶体;NaH的熔点显著高于NaOH,主要原因是 。
(4)某种单质铁的晶体为体心立方堆积,则铁原子的配位数为__________;若r(Fe)表示Fe原子的半径,单质铁的原子空间利用率为 [列出含r(Fe)的计算表达式)]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的化工产品之一,其生产方法也在逐渐改进中,各国科学家均在为提高氨的产量,降低能耗做各种有益的探究; 氨在工业上有广泛用途。
(1)合成氨用的 H2 可以 CH4 为原料制得。已知相关的化学键键能数据如下:
则 CH4(g)与 H2O(g)反应生成 CO(g)和 H2(g)的热化学方程式 。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了 较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是 。
(3)在 425℃、A12O3 作催化剂,甲醇与氨气反应可以制得(CH3)2NH。(CH3)2NH 显弱碱性,与盐酸反应 生成(CH3)2NH2Cl ,溶液中各离子浓度由小到大的顺序为 。
(4)直接供氨式碱性燃料电池的电池反应式 4NH3 + 3O2 = 2N2+ 6H2O,负极电极反应式为 。
(5)如下图,采用 NH3 作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含 量,从而确定烟气脱氮率,反应原理为:NO(g) +NO2(g)+2NH3(g)![]() 2N2(g) + 3H2O(g)。(注:脱氮率即氮氧化物转化率)
2N2(g) + 3H2O(g)。(注:脱氮率即氮氧化物转化率)

①对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也 可以表示平衡常数(记作 KP),则上述反应的 KP=_______。
②以下说法正确的是________。
A.上述反应的正反应为吸热反应。
B.相同条件下,改变压强对脱氮率没有影响。
C.催化剂①、②分别适合于 250℃和 450℃左右脱氮
D.曲线①、②最高点表示此时平衡转化率最高
(6)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。下图 为合成塔中不同氨碳比 a [n(NH3)/n(CO2)] 和水碳比 b [n(H2O)/n(CO2)]时二氧化碳转化率(x%)。b 宜控制在__________(填序号)范围内
CO(NH2)2(l)+H2O(g)。下图 为合成塔中不同氨碳比 a [n(NH3)/n(CO2)] 和水碳比 b [n(H2O)/n(CO2)]时二氧化碳转化率(x%)。b 宜控制在__________(填序号)范围内
A.0.6~0.7 B.1~1.1 C.1.5~1.6
a 宜控制在 4.0 左右,理由是___________。
(7)氨氧化法制硝酸工业中,可用尿素溶液除去尾气中氮氧化物(NO 和 NO2)。尾气中的 NO、NO2 与 水反应生成亚硝酸,亚硝酸再与尿素反应生成对大气无污染的气体。1 mol 尿素能吸收工业尾气中氮氧化 物(假设 NO、NO2 体积比为 1:1)的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
⑴ Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是_______。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
⑵ Li4SiO4可用于吸收、释放CO2,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生。写出CO2与Li4SiO4反应的化学方程式 ;该反应为_______(填“吸”或者“放”)热反应,原因是 _____________。
⑶ CO与H2在催化剂作用下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)。对此反应进行如下研究:某温度下在某2 L恒容密闭容器中分别充入1.2 mol CO和1 mol H2,达到平衡测得有0.4 mol CH3OH(g),则该反应平衡常数值为_______。
CH3OH(g)。对此反应进行如下研究:某温度下在某2 L恒容密闭容器中分别充入1.2 mol CO和1 mol H2,达到平衡测得有0.4 mol CH3OH(g),则该反应平衡常数值为_______。
⑷ 在200℃并用钴做催化剂的条件下,CO与H2可合成C5H12(汽油的一种成分),可减少碳排放。反应中能量变化如下图所示,写出该反应的热化学方程式______________。

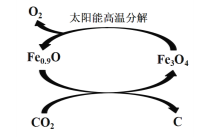
⑸ 如下图所示,利用缺铁氧化物[如Fe0.9O]可实现CO2的综合利用、构建低碳环保社会。请说明该转化的优点_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com