
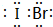 ,I与Br原子之间以共价键结合,属于共价化合物,
,I与Br原子之间以共价键结合,属于共价化合物,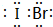 ;共价;共价.
;共价;共价.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
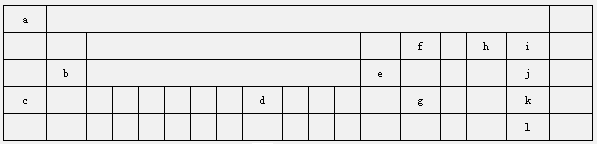
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度 | T1 | T2 | T2 |
| 反应物 起始量 | 0.5molA 1.5molB | 0.5molA 1.5molB | 2.0molA 6.0molB |
| A、由图可知:T1<T2,且该反应为吸热反应 |
| B、T2时该反应的平衡常数K=0.8 |
| C、前10min乙、丙两容器中v(A)乙>v(A)丙 |
| D、C的质量m:m甲=m乙<2m丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水中有下列平衡:Cl2+H2O?HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 |
| B、对2HI(g)?H2(g)+I2(g),平衡体系增大压强可使颜色变深 |
| C、反应CO+NO2?CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 |
| D、合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施(N2+3H2?2NH3;△H<0) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 微粒 | EO2- | EO3- |
| 立体构型名称 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加强城市生活污水脱氮除磷处理,遏制水体富营养化 |
| B、为防止电池中的重金属污染,废旧电池应作深埋处理 |
| C、积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 |
| D、大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com