
【题目】设![]() 为阿伏伽德罗常数的值.下列有关叙述正确的是
为阿伏伽德罗常数的值.下列有关叙述正确的是![]()
A.硝酸与铜反应得到![]() 、
、![]() 共23g,则铜失去的电子数为
共23g,则铜失去的电子数为![]()
B.10g![]() 的乙醇水溶液中所含氢原子数目为
的乙醇水溶液中所含氢原子数目为![]()
C.标准状况下![]() 的平均相对分子质量为
的平均相对分子质量为![]() 的
的![]() 与
与![]() 含有中子数
含有中子数![]()
D.1molCu与足量的S完全反应,转移电子数为![]()
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A.苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B.乙苯能发生氧化反应,但不能发生还原反应
C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D.苯乙烯在合适条件下催化加氢可生成乙基环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是( )
A. 纯碱溶液去油污 B. 加热氯化铁溶液颜色变深
C. 铁在潮湿的环境中生锈 D. 浓硫化钠溶液有臭味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下将0.2mol气体A充入10L恒容密闭容器中,进行反应:2A(g)+B(g) ![]() 2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如表所示,则下列说法正确的是( )
2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如表所示,则下列说法正确的是( )
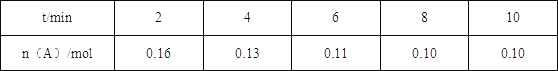
A.反应前2min的平均速率ν(C)=0.02molL﹣1min﹣1
B.平衡后降低温度,反应达到新平衡前ν(逆)>ν(正)
C.其他条件不变,10min后再充入一定量的A,平衡正向移动,A的转化率变小
D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,在如下密闭容器中(中间隔板可自由移动)左边充入amolSO2,bmolO2;右边充入cmolSO2、dmolO2,达平衡时如图,此时向两边各充入1mol氦气,则一段时间后重新达平衡,两边容器中SO2的转化率与原平衡相比较

A. 左增大,右减少 B. 左减小,右增大
C. 都不变 D. 都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. 氮原子的价电子排布图:![]()
B. 2p和3p轨道形状均为哑铃形,能量也相等
C. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
D. 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述与示意图一致的是:

A.图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g) → CH3CH3(g)ΔH<0;使用和未使用催化剂时,反应过程中的能量变化
B.图②表示25 ℃时,用0.01 mol·L-1盐酸滴定一定体积的0.01 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C.图③表示CH4(g)+H2O(g) ![]() CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
D.图④ 中曲线表示反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
A. 增加Ni的量可提高CO的转化率,Ni的转化率降低
B. 缩小容器容积,平衡右移,△H减小
C. 反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D. 当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物在工业生产、生活中具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H1=akJ·mol-1
②PbS(s)2PbO(s)=3Pb(s)+SO2(g) △H2=b kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H3=c kJ·mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s) △H=____________kJ·mol-1(用含a、b、c的代数式表示)
(2)以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:
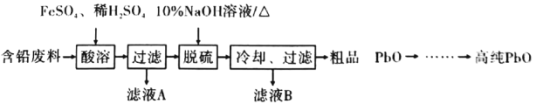
①“酸溶”时,在Fe2+催化下,Pb和PbO2反应成1 mol PbSO4时转移电子的物质的量为_________ mol。
②已知:PbO溶解在NaOH溶液中,存在化学平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图1所示:
NaHPbO2(aq),其溶解度曲线如图1所示:

结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,_______________(填 “趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(3)将粗品PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图2所示:

①阴极的电极反应式为______________________;
②当有4.14gPb生成时,通过质子交换膜的n(H+)=______________________。
(4)PbI2可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00 mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生反应:2RH++PbI2 =R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图3)。加入酚酞指示剂,用0.0050mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液10.00mL。可计算出t℃时Ksp(PbI2)为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com