
【题目】下列叙述中,错误的是( )
A.苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B.乙苯能发生氧化反应,但不能发生还原反应
C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D.苯乙烯在合适条件下催化加氢可生成乙基环己烷
科目:高中化学 来源: 题型:
【题目】在密闭容器里,发生反应2A(g)+B(g)![]() 2C(g)。下列条件不能说明该反应达到平衡的是
2C(g)。下列条件不能说明该反应达到平衡的是
A.2υ正(B)=υ逆(C)
B.该体系的密度不随时间而变化
C.该体系的温度不随时间而变化
D.1molA的化学键断裂,同时1molC的化学键也断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=﹣Q1kJmol﹣1
2H2(g)+O2(g)=2H2O(g)ΔH=﹣Q2kJmol﹣1,
2H2(g)+O2(g)=2H2O(l) ΔH2=﹣Q3kJmol﹣1
常温下,取体积比2∶3的甲烷和氢气的混合气体11.2 L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1+0.15Q2B.0.2Q1+0.05Q2C.0.2Q1+0.15Q3D.0.2Q1+0.3Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3Cl-
B.氢氧化钡溶液与硫酸铜溶液反应:Ba2++ SO![]() = BaSO4↓
= BaSO4↓
C.浓硫酸与铜反应:Cu+2H+= Cu2++H2↑
D.石灰石与稀醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3=__________(用含ΔH1、ΔH2的代数式表示)。
(2)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
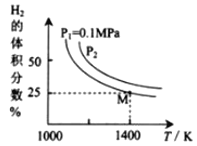
①由图可知,该反应的ΔH______0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为________(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=______(MPa)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25 ℃,0.01 mol/L的v溶液中:  = 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是
= 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是

A. 简单离子半径:W>Y>Z>X
B. W,Y分別与X元素形成的简单化合物的沸点: Y> W
C. Z2Y和ZX都只存在离子键
D. v能抑制水的电离,u能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取氧化钴(Co2O3)的流程如下:

(1)溶解Ⅰ:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是___________ 。所得滤渣的主要成分是___________ (写化学式)。
(2) 氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式____________ 。
(3) 某研究小组为测定黄钠铁矾[NaxFey(SO4)m(OH)n]的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI (反应为2Fe3++2I-=2Fe2++I2),用0.250 0 mol·L-1 Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3===2NaI+Na2S4O6),消耗30.00 mL Na2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后,得沉淀1.165 g。通过计算确定黄钠铁矾的化学式(写出计算过程) ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏伽德罗常数的值.下列有关叙述正确的是
为阿伏伽德罗常数的值.下列有关叙述正确的是![]()
A.硝酸与铜反应得到![]() 、
、![]() 共23g,则铜失去的电子数为
共23g,则铜失去的电子数为![]()
B.10g![]() 的乙醇水溶液中所含氢原子数目为
的乙醇水溶液中所含氢原子数目为![]()
C.标准状况下![]() 的平均相对分子质量为
的平均相对分子质量为![]() 的
的![]() 与
与![]() 含有中子数
含有中子数![]()
D.1molCu与足量的S完全反应,转移电子数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com