
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取氧化钴(Co2O3)的流程如下:

(1)溶解Ⅰ:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是___________ 。所得滤渣的主要成分是___________ (写化学式)。
(2) 氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式____________ 。
(3) 某研究小组为测定黄钠铁矾[NaxFey(SO4)m(OH)n]的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI (反应为2Fe3++2I-=2Fe2++I2),用0.250 0 mol·L-1 Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3===2NaI+Na2S4O6),消耗30.00 mL Na2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后,得沉淀1.165 g。通过计算确定黄钠铁矾的化学式(写出计算过程) ____________。
【答案】提高钴等元素的利用率 SiO2 6Fe2++6H++ClO3═6Fe3++Cl+3H2O NaFe3(SO4)2(OH)6
【解析】
(1)钴废催化剂加入稀硫酸,发生Co+H2SO4=CoSO4+H2↑,Fe+H2SO4=FeSO4+H2↑,过滤滤渣是不溶的二氧化硅,而滤液是硫酸钴、硫酸亚铁与过量的硫酸的混合溶液,向滤液中加氯酸钠将亚铁离子氧化成铁离子,然后加入碳酸钠得到黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,继续向滤液中加入碳酸钠,得到碱式碳酸钴[(CoCO3)23Co(OH)2],然后用盐酸溶解碱式碳酸钴[(CoCO3)23Co(OH)2],再向所到溶液中加入草酸铵,得到溶解度极小的草酸钴,最后燃烧生成氧化钴;
(2)亚铁离子被氯酸根离子氧化成铁离子,根据得失电子守恒分析解答;
(3)测定黄钠铁矾的原理是,加入碘化钾和黄钠铁矾中铁离子反应生成单质碘,碘和硫代硫酸钠反应,通过消耗硫代硫酸钠的量来计算铁的量,加入足量氯化钡和硫酸根离子生成硫酸钡沉淀,通过硫酸钡沉淀来计算硫酸根离子的量,根据质量守恒和电荷守恒计算钠离子和氢氧根离子的量,根据各微量物质的量之比写出黄钠铁矾的化学式。
(1)洗液与滤液合并,提高洗涤和滤液中钴的利用率,钴废催化剂加入稀硫酸,发生Co+H2SO4=CoSO4+H2↑,Fe+H2SO4=FeSO4+H2↑,过滤滤渣是不溶的二氧化硅,
故答案为:提高钴等元素的利用率;SiO2;
(2)亚铁离子被氯酸根离子氧化成铁离子,1mol的亚铁离子失去1mol的电子,而1mol的氯酸根离子得到6mol的电子,根据电子得失守恒,可知离子方程式为:6Fe2++6H++ClO3═6Fe3++Cl+3H2O,
答案为:6Fe2++6H++ClO3═6Fe3++Cl+3H2O;
(3)有关的反应离子方程式为:2Fe3++2I-=2Fe2++I2,I2+2Na2S2O3=2NaI+Na2S4O6,2Fe3+~I2~2Na2S2O3,n(Fe3+)=2n(I2)=n(Na2S2O3)=0.2500 molL-1×30.00 mL×10-3LmL-1=7.50×10-3 mol;
加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g为硫酸钡沉淀,则n(SO42-)=![]() =5.00×10-3mol,100 mL溶液中含有n(Fe3+)=7.50×10-3 mol×
=5.00×10-3mol,100 mL溶液中含有n(Fe3+)=7.50×10-3 mol×![]() =0.03 mol,n(SO42-)=5.00×10-3 mol×
=0.03 mol,n(SO42-)=5.00×10-3 mol×![]() =0.02 mol,设4.850g样品中钠离子的物质的量为n(Na+),氢氧根离子物质的量为n(OH-),根据质量守恒得:4.850g-0.03mol×56g/mol-0.02mol×96g/mol=n(Na+)×23g/mol+n(OH-)×17g/mol,根据电荷守恒得:0.03mol×3+n(OH-)×1=0.02mol×2+n(OH-)×1,解得:n(Na+)=0.01mol,n(OH-)=0.06 mol,则x:y:m:n=n(Na+):n(Fe3+):n(SO42-):n(OH-)=0.01:0.03:0.02:0.06=1:3:2:6, 化学式为NaFe3(SO4)2(OH)6,
=0.02 mol,设4.850g样品中钠离子的物质的量为n(Na+),氢氧根离子物质的量为n(OH-),根据质量守恒得:4.850g-0.03mol×56g/mol-0.02mol×96g/mol=n(Na+)×23g/mol+n(OH-)×17g/mol,根据电荷守恒得:0.03mol×3+n(OH-)×1=0.02mol×2+n(OH-)×1,解得:n(Na+)=0.01mol,n(OH-)=0.06 mol,则x:y:m:n=n(Na+):n(Fe3+):n(SO42-):n(OH-)=0.01:0.03:0.02:0.06=1:3:2:6, 化学式为NaFe3(SO4)2(OH)6,
故答案为:NaFe3(SO4)2(OH)6。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据要求完成下列各小题。
(1)由铜片、锌片和1L0.5mol/L的H2SO4(足量)组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36L(标准状况)的气体。请回答:
①负极是___(填“锌”或“铜”),发生___反应(填“氧化”或“还原”)。

②假设反应后溶液体积不变,反应后溶液的pH为___(用对数表示)。
(2)如图是某燃料电池的示意图,请回答:
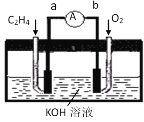
①在导线中电子流动方向为___(用a、b表示)。
②该燃料电池的负极反应式为___。
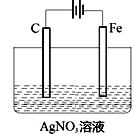
(3)如图是电解未知浓度的硝酸银溶液的示意图,请根据要求答题。
①Fe电极叫做___极,C电极的反应式为___。
②当某电极的固体质量增重21.6g时,整个装置共产生气体(标准状况下)体积2.24L,推断该气体的组成___(包括成分和体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A.苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B.乙苯能发生氧化反应,但不能发生还原反应
C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D.苯乙烯在合适条件下催化加氢可生成乙基环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.①2NO2![]() N2O4 ②N2O4
N2O4 ②N2O4![]() 2NO2,反应①的化学平衡常数是反应②的化学平衡常数的倒数
2NO2,反应①的化学平衡常数是反应②的化学平衡常数的倒数
B.已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,将0.05mol/LBa(OH)2溶液100.0mL与0.05mol/LH2SO4溶液100.0mL混合,在298K、101kPa条件下放热量为0.573kJ
C.已知298K 时,0.10mol/L HAc的电离度为1.32%。在0.10mol/L HAc和0.10mol/LNaAc的混合溶液20.00mL中,有如下变化:①HAc![]() H++Ac-,②NaAc=Na++Ac-,③Ac-+H2O
H++Ac-,②NaAc=Na++Ac-,③Ac-+H2O![]() HAc+OH-,向该溶液中滴入几滴稀盐酸,溶液的pH保持相对稳定
HAc+OH-,向该溶液中滴入几滴稀盐酸,溶液的pH保持相对稳定
D.将明矾与纯碱溶液混合,有沉淀产生,该沉淀的成分为碳酸铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大.金属W是制备手机电池的常用材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是它的电子层数的2倍。下列说法正确的是![]()
A.金属W具有两性
B.X、Z形成的化合物为离子化合物
C.Y与Z生成的化合物在水中会发生双水解
D.元素X与氢形成的原子个数比为1:1的化合物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是( )
A. 纯碱溶液去油污 B. 加热氯化铁溶液颜色变深
C. 铁在潮湿的环境中生锈 D. 浓硫化钠溶液有臭味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下将0.2mol气体A充入10L恒容密闭容器中,进行反应:2A(g)+B(g) ![]() 2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如表所示,则下列说法正确的是( )
2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如表所示,则下列说法正确的是( )
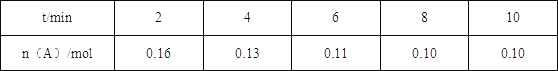
A.反应前2min的平均速率ν(C)=0.02molL﹣1min﹣1
B.平衡后降低温度,反应达到新平衡前ν(逆)>ν(正)
C.其他条件不变,10min后再充入一定量的A,平衡正向移动,A的转化率变小
D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
A. 增加Ni的量可提高CO的转化率,Ni的转化率降低
B. 缩小容器容积,平衡右移,△H减小
C. 反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D. 当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com