
【题目】下列说法正确的是
A.①2NO2![]() N2O4 ②N2O4
N2O4 ②N2O4![]() 2NO2,反应①的化学平衡常数是反应②的化学平衡常数的倒数
2NO2,反应①的化学平衡常数是反应②的化学平衡常数的倒数
B.已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,将0.05mol/LBa(OH)2溶液100.0mL与0.05mol/LH2SO4溶液100.0mL混合,在298K、101kPa条件下放热量为0.573kJ
C.已知298K 时,0.10mol/L HAc的电离度为1.32%。在0.10mol/L HAc和0.10mol/LNaAc的混合溶液20.00mL中,有如下变化:①HAc![]() H++Ac-,②NaAc=Na++Ac-,③Ac-+H2O
H++Ac-,②NaAc=Na++Ac-,③Ac-+H2O![]() HAc+OH-,向该溶液中滴入几滴稀盐酸,溶液的pH保持相对稳定
HAc+OH-,向该溶液中滴入几滴稀盐酸,溶液的pH保持相对稳定
D.将明矾与纯碱溶液混合,有沉淀产生,该沉淀的成分为碳酸铝
【答案】C
【解析】
A.在相同温度下,反应①的化学平衡常数才是反应②的化学平衡常数的倒数,A项错误;
B.Ba(OH)2和硫酸反应生成水和硫酸钡沉淀,生成硫酸钡沉淀也有热效应,所以将0.05mol/LBa(OH)2溶液100.0mL与0.05mol/LH2SO4溶液100.0mL混合,在298K、101kPa条件下放热量不等于0.573kJ,B项错误;
C.0.10mol/L HAc和0.10mol/LNaAc的混合溶液,相当于缓冲溶液,向该溶液中滴入几滴稀盐酸,HAc![]() H++Ac-,平衡逆向移动,溶液的pH保持相对稳定,C项正确;
H++Ac-,平衡逆向移动,溶液的pH保持相对稳定,C项正确;
D.将明矾与纯碱溶液混合,Al3+与CO32-水解相互促进,生成CO2和Al(OH)3白色沉淀,D项错误;
选C。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列有关离子方程式书写或离子共存说法正确的是( )
A.在0.1molL-1 Na2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存
B.常温下,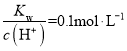 的溶液中,下列离子一定能大量共存:K+、Cl-、NO3-、Fe2+
的溶液中,下列离子一定能大量共存:K+、Cl-、NO3-、Fe2+
C.清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s) + CO32-(aq)![]() CaCO3(s) + SO42-(aq)
CaCO3(s) + SO42-(aq)
D.向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2+ + Al3+ + SO42- + OH- = BaSO4↓+ Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3Cl-
B.氢氧化钡溶液与硫酸铜溶液反应:Ba2++ SO![]() = BaSO4↓
= BaSO4↓
C.浓硫酸与铜反应:Cu+2H+= Cu2++H2↑
D.石灰石与稀醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25 ℃,0.01 mol/L的v溶液中:  = 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是
= 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是

A. 简单离子半径:W>Y>Z>X
B. W,Y分別与X元素形成的简单化合物的沸点: Y> W
C. Z2Y和ZX都只存在离子键
D. v能抑制水的电离,u能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释或结论中,错误的是![]()
A.利用NaOH溶液除去金属铝表面的氧化膜:![]()
B.NaCl溶液与![]() 溶液均呈中性,说明两溶液中水的电离程度相同
溶液均呈中性,说明两溶液中水的电离程度相同
C.1mol某醇与足量的钠反应生成![]() 氢气
氢气![]() 标况下
标况下![]() ,该醇为二元醇
,该醇为二元醇
D.向KI溶液中滴加氯水和![]() ,振荡,静置后溶液出现分层且下层显紫色,证明
,振荡,静置后溶液出现分层且下层显紫色,证明![]() 氧化性强于
氧化性强于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取氧化钴(Co2O3)的流程如下:

(1)溶解Ⅰ:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是___________ 。所得滤渣的主要成分是___________ (写化学式)。
(2) 氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式____________ 。
(3) 某研究小组为测定黄钠铁矾[NaxFey(SO4)m(OH)n]的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI (反应为2Fe3++2I-=2Fe2++I2),用0.250 0 mol·L-1 Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3===2NaI+Na2S4O6),消耗30.00 mL Na2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后,得沉淀1.165 g。通过计算确定黄钠铁矾的化学式(写出计算过程) ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.用![]() 溶液和
溶液和![]() 溶液反应制取
溶液反应制取![]() 固体
固体
B.加热蒸发![]() 溶液制取
溶液制取![]() 固体
固体
C.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl多
D.镀层破损后,镀锡铁板比镀锌铁板更易腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4 molA和2molB进行如下反应:
3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
A. 前2min,D的平均反应速率为0.2mol/(L·min)
B. 此时,B的平衡转化率是40%
C. 增加B,平衡向右移动,B的平衡转化率增大
D. 增大该体系的压强,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
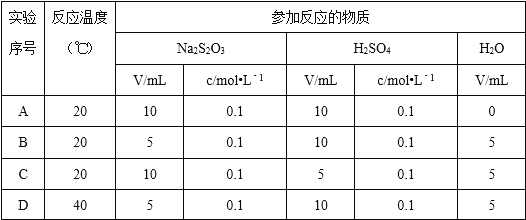
(1)写出上述反应的离子方程式__________。
(2)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是__________(填实验序号)。
(3)在利用比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件。其中:
①能说明温度对该反应速率影响的组合比较是__________;(填实验序号)
②A和B、A和C的组合比较所研究的问题是__________;
③B和C的组合比较所研究的问题是__________;
(4)教材是利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com