
【题目】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。碳是地球上组成生命的最基本的 元素之一。按要求回答:
(1)宇宙中含量最多的元素是氢和______。基态碳原子的核外电子占有______个原子轨道。
(2)光化学烟雾中除了含有 NOx 外,还含有 HCOOH、![]() (PAN)等二次污染物。
(PAN)等二次污染物。
①PAN 中 C 的杂化方式有______。1mol PAN 中含有的σ键数目为______。组成PAN 的元素的电负性大小顺序为______。
②相同压强下,HCOOH 的沸点比 CH3OCH3______(填“高”或“低”),
(3)水溶液中有 H3O+、H5O2+ 、H9O4 + 等微粒的形式。请画出 H5O2 的结构式:______。
(4)硅和碳在同一主族。下图为 SiO2 晶胞中 Si 原子沿 z 轴方向在 xy 平面的投影图(即俯视图),其 中 O原子略去,Si 原子旁标注的数字表示每个 Si 原子位于 z 轴的高度,则 SiA 与 SiB 之间的距离是______nm。
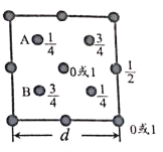 (d 的单位为 nm)
(d 的单位为 nm)
【答案】氦 4 sp2 sp3 10NA(或6.02×1024) O>N>C>H 高 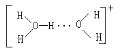
![]()
【解析】
(1)宇宙中氢元素占88.6%、氦占11.1%,宇宙中含量最多的元素是氢和氦;C的电子排布为1s22s22p2,1s和2s轨道上有2个电子,p能级有3个轨道,每个电子优先占据1个轨道,则基态碳原子核外电子占有4个轨道;
(2)①甲基的VSEPR模型为四面体构型,-COO-上C的VSEPR模型为平面三角形结构,则C原子的杂化类型分别为sp2、sp3;一个双键含有一个σ键,由PAN结构可知,一个![]() 中含有10个σ键,所以1molPAN中含有的σ键数目为10NA;PAN分子中含有C、H、N、O元素,元素的非金属性越强,其电负性越大,则电负性:O>N>C>H;
中含有10个σ键,所以1molPAN中含有的σ键数目为10NA;PAN分子中含有C、H、N、O元素,元素的非金属性越强,其电负性越大,则电负性:O>N>C>H;
②由于HCOOH存在分子间氢键,CH3OCH3只存在分子间作用力,所以HCOOH的沸点比CH3OCH3高;
(3)H5O2+是由水分子和H3O+通过氢键形成的微粒,则H5O2+的结构式为 ;
;
(4)根据图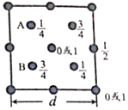 可知其三维模型为
可知其三维模型为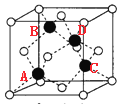 (图中黑球和白球均为硅原子,氧原子位于两个硅原子之间,省略),图中ABCD四个Si原子形成正四面体结构,且AB距离等于AC距离,AC距离在底面投影为底面面对角线的一半,则SiA与SiB的距离=
(图中黑球和白球均为硅原子,氧原子位于两个硅原子之间,省略),图中ABCD四个Si原子形成正四面体结构,且AB距离等于AC距离,AC距离在底面投影为底面面对角线的一半,则SiA与SiB的距离=![]() nm。
nm。


科目:高中化学 来源: 题型:
【题目】有机物C常用于食品行业。已知9.0gC在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2。
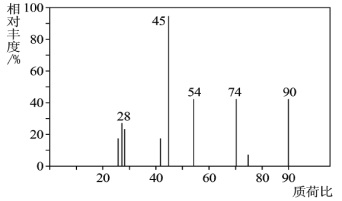
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是__,则C的分子式是__。
(2)C能与NaHCO3溶液发生反应,C一定含有的官能团是__。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则C的结构简式是__。
(4)0.1molC与1.0mol/L的氢氧化钠溶液反应,需溶液的体积是__mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①符合通式CnH2n+2 的烃一定都是烷烃,分子中均只含单键
②苯能使溴水褪色,说明苯环结构中含有碳碳双键
③乙酸与油酸一定不是同系物
④乙烯能使溴水和酸性KMnO4 溶液褪色,且反应类型相同
⑤![]() 与
与![]() 是同分异构体
是同分异构体
⑥相同质量的烃完全燃烧,耗氧量最大的是 CH4
⑦戊二酸的分子式是C5H8O4,符合此分子式的二元酸有 3 种
A.①③⑦B.①③⑥C.②⑥⑦D.④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是污染大气的主要物质之一。含二氧化硫的工业尾气可用如下方法来处理并制得有广泛用途的石膏。
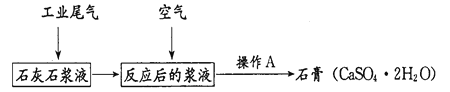
(1)SO2造成的一种常见环境污染为___;列举二氧化硫的一种用途___。
(2)SO2使紫色KMnO4溶液褪色的离子方程式为___;(提示:KMnO4 被还原为Mn2+)
(3)通空气时反应的化学方程式为___;若在实验室进行,操作A是_____。
(4)亚硫酸氢铵常用于造纸工业,若用某气体水溶液处理该工业尾气得到亚硫酸氢铵,则该气体为_______。
(5)有人提出在燃煤中加入适量的生石灰,可减少烟气中二氧化硫的排放,你认为是否合理?_______(填“合理”或“不合理”);理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A和元素B的原子序数都小于18,已知A原子的最外层电子数为a,次外层电子数为b,B原子的M层电子数为![]() ,且
,且![]() ,
,![]() 层电子数为a+b,则下列叙述不正确的是( )
层电子数为a+b,则下列叙述不正确的是( )
A.![]() 元素位于元素周期表中第3周期ⅣA族
元素位于元素周期表中第3周期ⅣA族
B.![]() 、
、![]() 两元素可形成化合物
两元素可形成化合物![]()
C.![]() 、
、![]() 两元素所形成的化合物能与碳反应
两元素所形成的化合物能与碳反应
D.![]() 、
、![]() 两元素所形成的化合物既能与氢氧化钠溶液反应又能与盐酸反应
两元素所形成的化合物既能与氢氧化钠溶液反应又能与盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以Zn(NH3)42+、Cu(NH3)42+、Cd(NH3)42+、AsCl52-的形式存在。
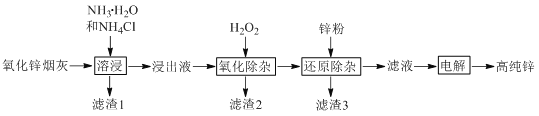
回答下列问题:
(1)Zn(NH3)42+中Zn的化合价为________,“溶浸”中ZnO发生反应的离子方程式为________。
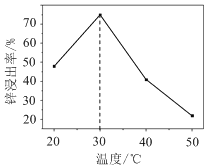
(2)锌浸出率与温度的关系如图所示,分析30 ℃时锌浸出率最高的原因为________。
(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为________。
(4)“滤渣3”的主要成分为________。
(5)“电解”时Zn(NH3)42+在阴极放电的电极反应式为_______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是________(写化学式)。电解后的电解液经补充________(写一种物质的化学式)后可返回“溶浸”工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSe 、MgB2等超导材料具有广阔的应用前景。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态Se原子的电子占据最高能级的电子云轮廓图为________形。
(2)向FeSe中嵌入吡啶(![]() )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________;该分子内存在________(填标号)。
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________;该分子内存在________(填标号)。
A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为________。
②液氨是氨气液化的产物,氨气易液化的原因是________。
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为________。
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有________个与之等距离且最近的B原子;六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA ,该晶体的密度为________ g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,对于指定项目的数目前后相等的是 ( )
A.电子数:17gOH—与1mol-OH
B.双键数目:1mol![]() 与4mol C2H4
与4mol C2H4
C.分子数:常温常压下16g氧气与4g氦气
D.阴离子总数:72gCaO2与62g Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与资源利用、材料研制、环境保护等密切相关。
(1)海水中蕴含的元素有80多种。
①海水中镁的总储量约为1.8×1015t,海水里镁的存在形式是__(填“游离态”或“化合态”)。
②氯碱工业是重要的化学工业之一,写出该反应原理的离子方程式:__。
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活。
①铁和铝是两种常见的金属材料,在空气中铝比铁耐腐蚀的原因是__。
②新型陶瓷氮化铝可用氧化铝高温还原法制备,化学方程式如下,请配平该化学反应方程式并标出电子转移方向和数目。_________
Al2O3+C+N2![]() AlN+CO
AlN+CO
(3)保持洁净安全的生存环境已成为全人类的共识。二氧化硫是引起酸雨的一种主要物质,必须严格控制排放。
①写出二氧化硫与足量NaOH溶液反应的离子方程式:__。
②酸雨降落到地面后,其中的亚硫酸在空气中被氧气逐渐氧化生成硫酸,使酸性进一步增强。写出这一过程的化学方程式:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com