
| X | Y |
| Z | W |
| A、W的气态氢化物的稳定性一定比Y的强 |
| B、Z元素的原子半径可能比Y元素的小 |
| C、W的原子序数可能是Y的原子序数的2倍 |
| D、若Z的最高正价为+m,则X的最高正价也一定为+m |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、BaCl2有两性 |
| B、两支试管的白色沉淀均是亚硫酸钡 |
| C、SO2有还原性和酸性氧化物的通性 |
| D、以上说法均不合理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S(g)+O2(g)=SO2(g)△H<-297.16 kJ/mol |
B、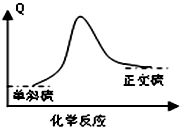 单斜硫转变为正交硫的能量变化可用图表示 |
| C、常温下正交硫比单斜硫稳定 |
| D、单斜硫转化为正交硫的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关该氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关该氢氧燃料电池的说法不正确的是( )| A、该电池工作时将化学能转化为电能 |
| B、电子从电极b经外电路流向电极a |
| C、该电池中的电极b是正极 |
| D、在电极a上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 |
| B、常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C、反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 |
| D、对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4 L氨气中含氢原子数目为3 NA |
| B、5.6 g铁与足量盐酸反应产生的氢分子数为0.2NA |
| C、标准状况下,4.48 L的氧气和氮气的混合物含有的分子数目为0.2 NA |
| D、80 g苛性钠溶于1L水中,所得溶液的物质的量浓度为2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同条件下,气体物质的量越大,气体摩尔体积越大 |
| B、通常状况下的气体摩尔体积大于22.4L/mol |
| C、非标准状况下的气体摩尔体积不可能为22.4L/mol |
| D、在标准状况下,混合气体的气体摩尔体积比22.4L/mol大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com