
【题目】常温下,用0.10mol·L-1的NaOH溶液滴定20.00mL浓度为0.10mol·L-1的HX溶液所得滴定曲线如下图(忽略溶液体积变化)。下列说法正确的是

A. 常温下K(HX)≈1×10-12
B. a点所示的溶液中:c(Na+)>c(X-)>c(OH-)=c(H+)
C. c点所示的溶液中:c(Na+)+c(HX)+c(X-)=0.10mol·L-1
D. 相同条件下,X-的水解能力弱于HX的电离能力
【答案】C
【解析】
A.由图象知0.10mol·L-1的HX溶液中c(H+)=1×10-6mol·L-1,HXH++X-,c(X-)=c(H+),c(HX)≈0.10mol·L-1,K(HX)=![]() =
=![]() =1×10-11,故A错误;
=1×10-11,故A错误;
B. a点时c(OH-)=c(H+),由电荷守恒原理知,c(Na+))=c(X-),故B错误;
C. c点时,酸碱恰好反应完全,体积变为原来的2倍,溶质为NaX,根据物料守恒知c(Na+)+c(HX)+c(X-)=0.10mol·L-1,故C正确;
D.b点时,反应生成的NaX的物质的量与剩余的HX的物质的量相等,由于此时混合溶液显碱性,说明X-水解程度大于HX电离程度,故D错误;
故选C。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】2017年5月9 日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如![]() 、
、![]() 等。下列说法正确的是( )
等。下列说法正确的是( )
A.![]() 和
和![]() 的化学性质不同
的化学性质不同
B.Ts位于周期表的第六周期ⅦA族
C.元素Ts的相对原子质量为293.5
D.![]() 和
和![]() 质子数相同,中子数不同
质子数相同,中子数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱除烟气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)以漂粉精溶液为吸收剂脱除烟气中的NO,相关热化学方程式如下:
ⅰ.4NO(g) + 3O2(g) + 2H2O(l) = 4HNO3(aq) H1 =﹣423 kJ·mol-1
ⅱ.Ca(ClO)2(aq) = CaCl2(aq) + O2(g) H2 =﹣120 kJ·mol-1
ⅲ.3Ca(ClO)2(aq) + 4NO(g) + 2H2O(l) = 4HNO3(aq) + 3CaCl2(aq) H3
① H3 = _______kJ·mol-1 。
② 反应ⅲ的平衡常数随温度升高的变化趋势是________。
(2)HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。C12和Ca(OH)2制取漂粉精的化学方程式是________。
(3)次氯酸盐脱除NO的主要过程如下:
a.NO+HClO = NO2+HCl
b.NO + NO2+H2O 2HNO2
c.HClO+ HNO2 = HNO3+HCl
下列分析正确的是________。
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
(4)研究不同pH、不同温度下漂粉精溶液对NO脱除率的影响,结果如图1、图2。
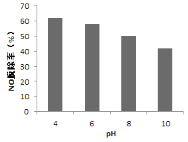

图1 图2
① 图1中,pH降低NO脱除率增大的原因:________。
② 脱除过程中往往有Cl2产生,原因是________(用离子方程式表示)。
③ 图2中,60~80℃ NO脱除率下降的原因:________。(至少答出两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示![]() 、
、![]() 装置电解氯化铜溶液和饱和食盐水。下列判断错误的是( )
装置电解氯化铜溶液和饱和食盐水。下列判断错误的是( )

A. 阳极失电子的离子相同、产物相同
B. 阴极产物因得电子的离子不同而不同
C. 电解后两装置中溶液的pH都减小
D. 电解后只有![]() 装置阴极的质量增加
装置阴极的质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于( )

A.锌和盐酸生成氢气
B.氯酸钾和二氧化锰生成氧气
C.碳酸钙和盐酸生成二氧化碳
D.氯化钠和浓硫酸生成氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点是390℃,沸点是430℃,溶于冷水,遇热水则强烈水解。在380~400℃时锂与氨气直接反应可制得LiNH2,下面是实验室制备LiNH2时可能用到的装置图,回答下列问题。

(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是___________(填宇母)。
A.浓氨水、CaO B.NH4Cl固体、Ca(OH)2固体
C.浓氨水 D.NH4NO3固体、NaOH固体
(2)用(1)中合适的试剂制取的NH3按气流方向自左向右,则图中装置的连接顺序为___________(填接口处宇母),装置A的作用是______________________。
(3)装置C中仪器的名称是___________,盛装的试剂是___________。实验开始后,向X中通入NH3与加热仪器X的先后顺序为___________。
(4)实验室还可用浓氨水与固体NaOH混合制备氨气,但多次实验表明,此方法收集到的NH3量总是比理论值低许多,其最可能的原因是______________________。
(5)氨基锂能与热水反应生成LiOH与一种气体,请推测该气体的成分并用实验验证你的结论:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①5.2g的气态乙炔(C2H2)在氧气中燃烧,生成二氧化碳和液态水,放出260kJ的热量,其热化学方程式为:___________________________________________________________。又知H2O(l)==H2O(g)△H= +44kJ/mol,则11.2L(标准状况)乙炔完全燃烧生成气态水时放出的热量是_________kJ。
②已知:CH4 的燃烧热为890 kJ/mol,H2的热值为142.5kJg-1,现有标准状况下22.4 L CH4和H2的混合气体完全燃烧时,放出的热量为527kJ,求混合气体中CH4 和H2的体积比_____________
③将1mol NO2投入到1L容器中进行 2NO2(g)![]() N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是由X和Y两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如右图所示的转化关系。下列说法不正确的是

A. X、Y、Z三种元素能组成离子化合物
B. 反应②为化合反应,反应③为置换反应
C. 常温常压下,Z的简单氢化物的熔沸点为同族最高
D. 原子半径:Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为四种由短周期元素构成的中性粒子,它们都有14个电子,且都是共价形分子。回答下列问题:
(1)a是单核分子,a单质可用作半导体材料,a原子核外电子排布式为____________________。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为________。人一旦吸入b气体后,就易引起中毒,是因为_______________________________________________而中毒。
(3)c是双核单质,写出其电子式____________________________________________。c分子中所含共价键的类型为____________(填“极性键”或“非极性键”)。c单质常温下性质稳定,不易起反应,原因是______________________________________________。
(4)d是四核化合物,其结构式为____________________________________________;d分子内所含共价键有________个σ键,________个π键;σ键与π键的强度大小关系为σ______π(填“>”、“<”或“=”),原因是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com