
【题目】实验装置用于验证NaHCO3的稳定性,做了如下下实验。D为固定蚊香的硬纸片。试回答下列问题:

(1)在A试管内发生反应的化学方程式是_________________________。
(2)在双球干燥管内发生反应的化学方程式为_______________________________。
(3)双球干燥管内观察到的实验现象是_________________________。通过上面的实验现象某同学受到启发用如图所示装置制取纯净的氧气.试回答下列问题:
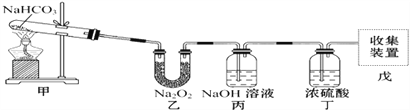
(4)丙中NaOH溶液的作用是______________,丁中浓硫酸的作用是____________。
(5)若把原装置连接顺序改为甲→丙→乙→丁→戊,则在装置戊中能否收集到氧气?____(填“能”或“不能”),原因是___________________________________________。
【答案】 2NaHCO3![]() Na2CO3+H2O+CO2↑ 2Na2O2+2CO2=2Na2CO3+O2 淡黄色物质变成白色固体,蚊香燃烧剧烈 吸收生成的CO2 除去水 能 甲产生的CO2和H2O经过丙装置除去CO2后水蒸汽可以与Na2O2反应生成O2,经过丁干燥可以得到纯净的O2
Na2CO3+H2O+CO2↑ 2Na2O2+2CO2=2Na2CO3+O2 淡黄色物质变成白色固体,蚊香燃烧剧烈 吸收生成的CO2 除去水 能 甲产生的CO2和H2O经过丙装置除去CO2后水蒸汽可以与Na2O2反应生成O2,经过丁干燥可以得到纯净的O2
【解析】(1)依据装置分析判断A试管中是加热碳酸氢钠固体的反应生成碳酸钠、二氧化碳和水,反应的化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑;(2)B中盛的是浓硫酸起到吸收水蒸气干燥二氧化碳气体,因此在双球干燥管内二氧化碳与过氧化钠反应,发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;(3)根据以上分析可知双球干燥管内过氧化钠吸收二氧化碳生成碳酸钠和氧气,氧气是助燃性气体,则观察到的实验现象是淡黄色物质变成白色固体,蚊香燃烧剧烈;(4)加热碳酸氢钠固体的反应生成碳酸钠、二氧化碳和水,二氧化碳和水与过氧化钠均反应生成氧气,反应中二氧化碳过量,所以丙中NaOH溶液的作用是吸收生成的CO2,另外生成的氧气中含有水蒸气,则丁中浓硫酸的作用是除去水。(5)由于甲产生的CO2和H2O经过丙装置除去CO2后水蒸汽可以与Na2O2反应生成O2,经过丁干燥可以得到纯净的O2,因此可以收集到氧气。
Na2CO3+H2O+CO2↑;(2)B中盛的是浓硫酸起到吸收水蒸气干燥二氧化碳气体,因此在双球干燥管内二氧化碳与过氧化钠反应,发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;(3)根据以上分析可知双球干燥管内过氧化钠吸收二氧化碳生成碳酸钠和氧气,氧气是助燃性气体,则观察到的实验现象是淡黄色物质变成白色固体,蚊香燃烧剧烈;(4)加热碳酸氢钠固体的反应生成碳酸钠、二氧化碳和水,二氧化碳和水与过氧化钠均反应生成氧气,反应中二氧化碳过量,所以丙中NaOH溶液的作用是吸收生成的CO2,另外生成的氧气中含有水蒸气,则丁中浓硫酸的作用是除去水。(5)由于甲产生的CO2和H2O经过丙装置除去CO2后水蒸汽可以与Na2O2反应生成O2,经过丁干燥可以得到纯净的O2,因此可以收集到氧气。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: ①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50﹣60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.已知
(i) ![]() +HNO3(浓)
+HNO3(浓) ![]()
![]() +H2O
+H2O 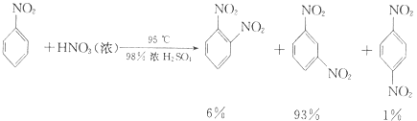
(ii)可能用到的有关数据列表如下
物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/gcm﹣3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
1,3﹣二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
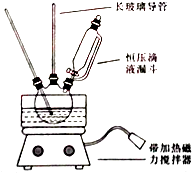
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 .
(2)恒压滴液漏斗的优点是 .
(3)实验装置中长玻璃管可用代替(填仪器名称).
(4)反应结束后产品在液体的层(填“上”或者“下”),分离混酸和产品的操作方法为
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? .
(6)为了得到更纯净的硝基苯,还须先向液体中加入除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列溶液做导电实验,其中灯泡最亮的是 ( )
A. 1mol/L 的NaCl溶液 B. 75%的乙醇溶液
C. 90%的蔗糖溶液 D. 1mol/L 的CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。

回答下列问题:
(1)检验滤液中的![]() 的方法是____________。
的方法是____________。
(2)试剂I的化学式为__________,加入试剂I后,①对应的实验操作是____,①中发生反应的离子方程式为__________。
(3)试剂II的化学式为_________,②中加入试剂II的目的是______。
(4)试剂III的名称是________,③中发生反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是高中阶段学习的常见单质或化合物,金属单质A在常温下可以和氧气生成化合物C,且A可以和氢氧化钠溶液反应。化合物E淡黄色物质,可用于呼吸面具,可由一种活泼金属D在氧气中燃烧得到。单质B是所含元素在地壳中含量居于第四。回答问题:
(1)物质E的化学式___________,E与水反应的离子方程式____________________。
(2)单质A与NaOH反应的离子方程式_______________________,化合物C与硫酸反应的离子方程式:_______________________________。
(3)单质B与水蒸汽反应的化学方程式为___________________________________。
(4)单质D与CuSO4溶液反应的化学方程式为__________________________。
(5)活泼金属D与水的反应中,做___________(填“氧化剂”或“还原剂”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置。
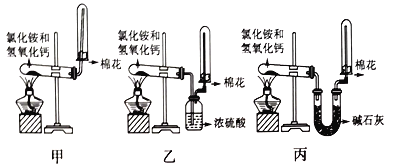
(1)写出实验室制氨气的化学反应方程式:_________________。
(2)实验室装置和所用样品都正确的是_________(填“甲”、“乙”、 “丙”)。
(3)检验试管里是否收集满了氨气的方法是:__________________。
(4)上述装置中,其中的一个装置肯定收集不到氨气的是_______,原因是(用化学方程式表示)___________________________。
(5)尾气处理时: 选择不可以用于处理氨气的________。
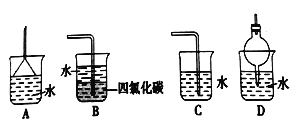
(6)氨的催化氧化是工业制硝酸的基础反应,写出反应的化学方程式__________。
II. 将红热的固体单质甲放入显黄色的溶液乙中剧烈反应产生混合气体A,A 在常温下不与空气作用,有如下变化关系:
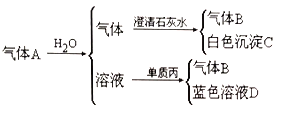
①推导出各物质的化学式B_______C________D________。
②写出甲跟乙反应的化学方程式:__________。A 溶于水发生的化学方程式__________。丙生成B 的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 1.8×10﹣10 | 5.0×10﹣13 | 8.3×10﹣17 | 2.0×10﹣48 | 1.8×10﹣10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的( )
A.KBr
B.KI
C.K2S
D.K2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 氢氧化铁与盐酸反应:H++OH![]() H2O B. NaHSO4溶液与NaOH反应:H+ + OH=H2O
H2O B. NaHSO4溶液与NaOH反应:H+ + OH=H2O
C. 铁与H2SO4反应:Fe+2H+![]() Fe3++H2↑ D. NaHCO3溶于盐酸中:CO32- +2H+
Fe3++H2↑ D. NaHCO3溶于盐酸中:CO32- +2H+![]() CO2↑+H2O
CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com