
【题目】下列离子方程式书写正确的是 ( )
A. 氢氧化铁与盐酸反应:H++OH![]() H2O B. NaHSO4溶液与NaOH反应:H+ + OH=H2O
H2O B. NaHSO4溶液与NaOH反应:H+ + OH=H2O
C. 铁与H2SO4反应:Fe+2H+![]() Fe3++H2↑ D. NaHCO3溶于盐酸中:CO32- +2H+
Fe3++H2↑ D. NaHCO3溶于盐酸中:CO32- +2H+![]() CO2↑+H2O
CO2↑+H2O
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
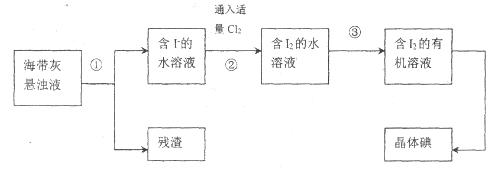
(1)操作③可选用的有机试剂是________(只填一种)。步骤②生成![]() 的离子方程式_______。
的离子方程式_______。
(2)操作过程③可以分解为如下几步:
A.将分液漏斗放在铁架台的铁圈中静置、分层;
B.把50.0 mL碘水和15.0mL所选有机溶剂加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.将漏斗上口玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准,旋开活塞,用烧杯接收液体;
F.从分液漏斗上口倒出上层液体;
(a)过程③正确操作步骤的顺序是(填编号字母)__________;
(b)上述E步操作中“将漏斗上口玻璃塞上的凹槽对准小孔”的目的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验装置用于验证NaHCO3的稳定性,做了如下下实验。D为固定蚊香的硬纸片。试回答下列问题:

(1)在A试管内发生反应的化学方程式是_________________________。
(2)在双球干燥管内发生反应的化学方程式为_______________________________。
(3)双球干燥管内观察到的实验现象是_________________________。通过上面的实验现象某同学受到启发用如图所示装置制取纯净的氧气.试回答下列问题:
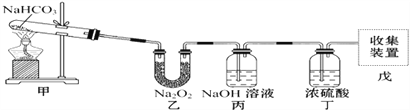
(4)丙中NaOH溶液的作用是______________,丁中浓硫酸的作用是____________。
(5)若把原装置连接顺序改为甲→丙→乙→丁→戊,则在装置戊中能否收集到氧气?____(填“能”或“不能”),原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮的固定的说法错误的是
A.氮的固定包括人工固氮和自然固氮
B.工业合成氨属于人工固氮
C.自然固氮中氮元素被氧化
D.氮的的固定中参与元素至少有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不符合人与自然和谐相处的是
A.很多城市对废旧电池进行回收处理
B.许多国家对废旧塑料垃圾进行了深埋处理
C.现在不少地区正在使用沼气、太阳能、风能等能源替代传统的煤炭
D.许多地方政府出台相关法规来保护生物物种多样性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Cu、Fe、Cl、O、N是常见的6种元素.
(1)Fe位于元素周期表第周期第族;O的基态原子核外有个未成对电子.Cu的基态原子电子排布式为 .
(2)用“>”或“<”填空:
第一电离能 | 原子半径 | 稳定性 |
NO | CNa | NH3H2O |
(3)液态N2H4与液态N2O4反应生成气态水,在25℃、101kPa下,已知该反应每消耗1mol N2H4放出519.85kJ的热量,该反应的热化学反应方程式是:
(4)古老的但仍是最有用的制备N2H4的方法是NaClO溶液氧化过量的NH3 , 写出该反应的离子方程式,并标出电子转移的方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物
B.碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力
C.氧气和臭氧间的相互转化属于氧化还原反应
D.有机化合物CH3—CH2—NO2和H2N—CH2—COOH是同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2 , 引起了各国的普遍重视.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,
在体积为1L的密闭容器中,充入1mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率 v (H2)=mol/(Lmin).
②该反应的平衡常数表达式为 .
③下列措施中能使 n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(2)①在载人航天器的生态系统中,不仅要求分离去除CO2 , 还要求提供充足的O2 . 某种电化学装置可实现如下转化:2CO2═2CO+O2 , CO可用作燃料.
已知该反应的阳极反应为:4OH﹣﹣4e﹣═O2↑+2H2O则阴极反应式为:
②有人提出,可以设计反应2CO═2C+O2(△H>0、△S<0)来消除CO的污染.请你判断是否可行并说出理由:;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的化工原料资源,可以从海水中提取各种化工原料.如图是工业上对海水的几项综合利用的示意图:试回答下列问题: 
(1)粗盐中含有Ca2+、Mg2+、SO42﹣等杂质,除去Mg2+所用试剂为 .
A.过量盐酸
B.过量BaCl2溶液
C.过量NaOH溶液
D.过量Na2CO3溶液
(2)电解饱和食盐水时,阴极反应为 . 若欲将电解后饱和食盐水恢复至电解前,则可采取的方法是
(3)由MgCl26H2O晶体脱水制无水MgCl2时,MgCl26H2O晶体应在通入气体的气氛中加热脱水,该气体的作用是 .
(4)电解无水MgCl2所得的镁蒸气可以在下列气体中冷却.
A.Ar
B.N2
C.CO2
D.O2 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com