
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
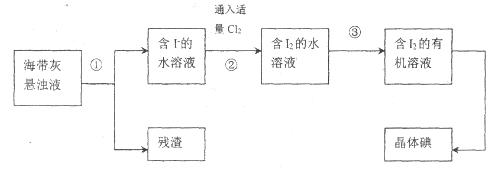
(1)操作③可选用的有机试剂是________(只填一种)。步骤②生成![]() 的离子方程式_______。
的离子方程式_______。
(2)操作过程③可以分解为如下几步:
A.将分液漏斗放在铁架台的铁圈中静置、分层;
B.把50.0 mL碘水和15.0mL所选有机溶剂加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.将漏斗上口玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准,旋开活塞,用烧杯接收液体;
F.从分液漏斗上口倒出上层液体;
(a)过程③正确操作步骤的顺序是(填编号字母)__________;
(b)上述E步操作中“将漏斗上口玻璃塞上的凹槽对准小孔”的目的是___________。
【答案】 CCl4(或苯、汽油等) Cl2+2I-=2Cl-+I2 CBDAEF 使分液漏斗内的气压与大气压相同,液体能够顺利流下
【解析】试题分析:本题以海带为原料提取单质碘的流程为载体,考查离子方程式的书写,萃取分液实验。
(1)操作③为将含I2的水溶液→含I2的有机溶液,即加入的有机试剂将I2萃取到有机层中,可选用CCl4、苯、汽油等。步骤②通入适量Cl2将I-氧化成I2,反应的离子方程式为Cl2+2I-=2Cl-+I2。
(2)(a)操作③为萃取分液实验,萃取分液实验的步骤为:检查分液漏斗是否漏液→混合振荡→静置→分液;则过程③正确操作步骤的顺序是:CBDAEF。
(b)E步操作中“将漏斗上口玻璃塞上的凹槽对准小孔”的目的是:使分液漏斗内的气压与大气压相同,液体能够顺利流下。


科目:高中化学 来源: 题型:
【题目】电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极). 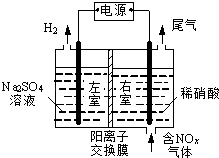
(1)若用NO2气体进行模拟电解法吸收实验. ①写出电解时NO2发生反应的电极反应式: .
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为mol.
(2)某小组在右室装有10L0.2molL﹣1硝酸,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验. ①实验前,配制10L0.2molL﹣1硝酸溶液需量取mL的密度为1.4gmL﹣1、质量分数为63%的浓硝酸.
(3)②电解过程中,有部分NO转化为HNO2 , 实验结束时,测得右室溶液中含3molHNO3、0.1molHNO2 , 同时左室收集到标准状况下28LH2 . 计算原气体中NO和NO2的体积比(假设尾气中不含氮氧化物,写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: ①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50﹣60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.已知
(i) ![]() +HNO3(浓)
+HNO3(浓) ![]()
![]() +H2O
+H2O 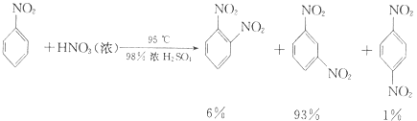
(ii)可能用到的有关数据列表如下
物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/gcm﹣3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
1,3﹣二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
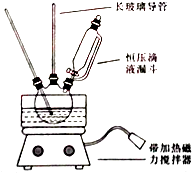
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 .
(2)恒压滴液漏斗的优点是 .
(3)实验装置中长玻璃管可用代替(填仪器名称).
(4)反应结束后产品在液体的层(填“上”或者“下”),分离混酸和产品的操作方法为
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? .
(6)为了得到更纯净的硝基苯,还须先向液体中加入除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血红蛋白中含有Fe2+,如果误食亚硝酸盐会使人中毒,因为亚硝酸盐会使Fe2+转变成Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素c可缓解亚硝酸盐中毒,说明维生素c具有
A. 氧化性B. 还原性C. 酸性D. 碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NH3H2O的电离平衡常数Kb=1.75×10﹣5 , 该温度下,用0.01molL﹣1盐酸滴定10mLamolL﹣1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( ) 
A.A点溶液中加少量水, ![]() 减小
减小
B.原氨水的物质的量浓度约为1.006×10﹣2mol?L﹣1
C.B,D两点溶液中水电离出来的c(OH﹣):B<0
D.C点溶液中的H2O不发生电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列溶液做导电实验,其中灯泡最亮的是 ( )
A. 1mol/L 的NaCl溶液 B. 75%的乙醇溶液
C. 90%的蔗糖溶液 D. 1mol/L 的CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。

回答下列问题:
(1)检验滤液中的![]() 的方法是____________。
的方法是____________。
(2)试剂I的化学式为__________,加入试剂I后,①对应的实验操作是____,①中发生反应的离子方程式为__________。
(3)试剂II的化学式为_________,②中加入试剂II的目的是______。
(4)试剂III的名称是________,③中发生反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 氢氧化铁与盐酸反应:H++OH![]() H2O B. NaHSO4溶液与NaOH反应:H+ + OH=H2O
H2O B. NaHSO4溶液与NaOH反应:H+ + OH=H2O
C. 铁与H2SO4反应:Fe+2H+![]() Fe3++H2↑ D. NaHCO3溶于盐酸中:CO32- +2H+
Fe3++H2↑ D. NaHCO3溶于盐酸中:CO32- +2H+![]() CO2↑+H2O
CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com