
【题目】硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)—炭粉还原法,其流程示意图如下:

(1)上述流程中“碱浸”后,物质A必须经过 (填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为 。
(2)上述流程中采用稀碱液比用热水更好,理由是稀碱液能 Na2S水解(选促进或抑制)
(3)取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)= mol·L-1。(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)

(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如右图所示)。为使除汞效果最佳,应控制的条件是x控制 、pH控制 。
②某毛纺厂废水中含0.001 mol·L-1的硫化钠,与纸张漂白后的废水(含0.002 mol·L-1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有 。
【答案】(1)过滤、干燥 3Na2SO4+8C![]() 3Na2S+4CO2↑+4CO↑
3Na2S+4CO2↑+4CO↑
(2)抑制(3)4×10-36
(4)① x=12 pH介于9~10之间②SO42-、Cl-
【解析】
试题分析:(1)上述流程中加入了过量的碳粉,“碱浸”后,物质碳粉必须经过过滤、干燥处理后,方可“煅烧”;若煅烧所得气体为等物质的量的CO和CO2,根据得失电子守恒、原子守恒煅烧时发生的总的化学反应方程式为3Na2SO4+8C![]() 3Na2S+4CO2↑+4CO↑;(2)硫化钠是强碱弱酸盐,加热促进硫化钠水解,稀碱液抑制Na2S水解,所以采用稀碱液比用热水更好;(3)根据硫化铜、氢氧化铜的Ksp可知
3Na2S+4CO2↑+4CO↑;(2)硫化钠是强碱弱酸盐,加热促进硫化钠水解,稀碱液抑制Na2S水解,所以采用稀碱液比用热水更好;(3)根据硫化铜、氢氧化铜的Ksp可知![]() 、
、![]() , pH=4,
, pH=4,![]() ,
,![]() , c( S2-)=4×10-36mol·L-1。(4)①根据图示应控制的条件是x控制12、pH控制9~10之间。
, c( S2-)=4×10-36mol·L-1。(4)①根据图示应控制的条件是x控制12、pH控制9~10之间。
②次氯酸钠与硫化钠的氧化产物是硫酸钠,硫化钠的物质的量比是0.001×1:0.002×2=1:4,次氯酸钠的还原产物是Cl-,根据得失电子守恒,硫化钠的氧化产物是硫酸钠,处理后的废水中所含的主要阴离子有SO42-、Cl-。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。五种元素均位于短周期,X、W的质子数之和为23。下列说法正确的是
![]()
A. Y元素的最高价氧化物的水化物是含氧酸中酸性最强的
B. W和R只能形成一种化合物WR3,且为酸性氧化物
C. X的最高价含氧酸与它的简单气态氢化物发生氧化还原反应
D. Z与R形成的化合物ZR2是生产光纤制品的基本原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
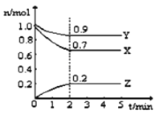
(1)由图中所给数据进行分析,该反应的化学方程式为 。
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)= 。
(3)2min反应达平衡容器内混合气体的平均相对分子质量比起始时 (填增大、减小或不变),混合气体密度比起始时 (填增大、减小或不变)。
(4)下列措施能加快反应速率的是 。
A.恒容时充入X B.及时分离出Z C.降低温度 D.选择高效的催化剂
(5)下列说法正确的是 。
A.升高温度可以改变化学反应的平衡状态
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.达到化学反应的平衡状态与时间长短无关
D.化学反应的平衡状态是不可能改变的
E.增大Y的浓度,正反应速率加快,逆反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36, Y基态原子最外层电子数是其内层电子总数的3倍,X、W基态原子是同周期元素中未成对电子数最多的原子,X与Z的原子核内质子数之和等于W原子核内质子数,Z基态原子只有1个未成对的电子。
回答下列问题:
(1)已知化合物XZ3与H2Y(Y的氢化物)发生反应的化学方程式为XZ3+H2Y→XH3+HZY,则元素的电负性:Y Z(填“大于”或“小于”),化合物HZY分子的空间构型为 。
(2)X的一种氢化物的相对分子质量为32,1mol该氢化物中的σ键数是 ,该氢化物在水中的溶解性如何?主要原因是什么?
(3)元素Y 3个原子形成的单质分子与元素X、Y形成的一种离子互为等电子体,这种离子的化学式是 。
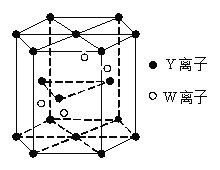
(4)基态W原子的电子排布式是 ,元素Y和W的一种化合物的晶体结构如右图所示,该晶体的化学式为 。(W处于晶体内部,Y分别处于晶胞面心、顶点、和内部)
(5)金属原子 (选填“钾”、“镁”、“铜”)形成的晶体的堆积方式,与上述晶胞中Y离子的堆积方式相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向纯水中加入少量NaHSO4,在温度不变时,溶液中( )
A.c(H+)/c(OH-)增大 B.c(H+)减小
C.水中c(H+)与c(OH-)的乘积增大 D.c(OH-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
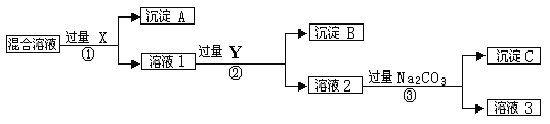
请回答下列问题:
(1)写出实验流程中下列物质的化学式。试剂X : ,沉淀A: ,试剂Y: ,沉淀B: 。
(2)上述实验流程中加入过量的Na2CO3的目的是 。
(3)按此实验方案得到的溶液3中肯定含有 (填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的 ,之后若要获得固体NaNO3需进行的实验操作是 (填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种描述中,不正确的是( )
A. 绿色食品是不含任何化学物质的食品
B. 加碘食盐中所加的“碘”一般是碘酸钾
C. 区别氯化铁溶液和氢氧化铁胶体可以用丁达尔效应
D. 用湿润的有色布条可以检验氯化氢气体中是否混有氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.H+、Na+、CO32﹣
B.Cl﹣、Ba2+、SO42﹣
C.Fe3+、OH﹣、SO42﹣
D.H+、Ag+、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】属于氧化还原反应的离子方程式的是 ( )
A. CaCO3+2H+ = Ca2++CO2↑+H2O B. 2Fe2++Cl2 = 2Fe3++2Cl
C. HCO3+H+ = CO2+H2O D. 2Na+2H2O = 2NaOH +H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com