
【题目】除去乙酸乙酯中残留的乙酸,有效的处理方法是
A. 蒸馏 B. 用过量饱和碳酸钠溶液洗涤后分液
C. 水洗后分液 D. 用过量的氢氧化钠溶液洗涤后分液
科目:高中化学 来源: 题型:
【题目】已知反应①、②、③中都涉及到MnO2,反应关系如图所示,其中E、M、H为中学化学常见的气体单质,E为黄绿色,M、H均为无色。G有漂白性,N的焰色反应为紫色(透过蓝色钻玻璃观察)。

请回答:
(l)在反应①、②中,MnO2的作用分别是_________、________。
(2)在图中反应①~⑦中,属于氧化还原反应的是______(填序号)
a.除④外 b. 除①⑤⑥外 c.除④⑦外 d.全部
(3)请写出下列反应的离子方程式:
反应①______________;反应④______________;反应⑥______________;
(4)若amolE气体、b molM气体、cmolH气体,在一定条件下恰好完全反应,得到A溶液,则a、b、c的关系为___________。(用含有a、b、c的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量CuO粉末与0.5L稀硫酸充分反应后,将一根50g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24g,并收集到224mL H2(标准状况).由此推知CuO粉末的质量为( )
A.1.92g
B.2.4g
C.6.4g
D.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中的化学电源、金属冶炼、环境污染等都与氧化还原反应息息相关,研究氧化还原反应,对人类进步和社会发展都具有极其重要的意义。
(1)已知下列反应在一定条件下可以发生:H2O2+2Fe2++2H+=2Fe3++2H2O;H2O2+2Fe3+= 2Fe2++2H+ +O2↑
①通过观察以上两个反应,对其中Fe2+的认识是 __________________。
②I2和Fe2+一样也能与H2O2发生上述类似反应,类比上述反应,在下面空格上填入合适的化学方程式:H2O2+I2= 2HIO;___________。总的化学方程式为_____________________________。
(2)2017年4月1日,中共中央、国务院印发通知,决定设立河北雄安新区。据报道周边污水渗坑给雄安新区的水环境带来隐患,目前采用多种方法对污水进行处理,改善水资源状况。
①碱性环境下,Cl2可将水中残存的CN-转化为两种无毒的气体,则该反应生成两种无毒气体的物质的量之比为_________________。
②酸性环境下,向含重铬酸根(Cr2O72-)的废水中加入FeSO4溶液,然后调节溶液pH,使生成的Cr3+转化为Cr(OH)3,写出第一步反应对应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】融雪剂通过降低冰雪融化温度的原理融化道路上的积雪。研究发现,一般融雪剂残留物可腐蚀路面和汽车轮胎等。目前我国北方在冬季仍采用沙土和铲雪车为主,融雪剂为辅的方式清除路面冰雪,保证道路通畅。
请回答下列问题:
(1)氯化钙是常用融雪剂的主要成分之一,以工业碳酸钙(含有少量Na+、Mg2+、Fe3+等杂质)生产氯化钙的主要流程如下:

①流程中试剂W的名称是 ________________。
②流程中滤渣的主要成分是________________(填化学式)。
③流程中操作Y的目的是_______________。
④如果用惰性电极电解用试剂W溶解后的溶液,则电解开始时阴极发生的电极反应式为_________。
(2)下列就融雪剂使用的有关原理的解释正确的是_________________。
A.“会加快冰雪的融化”是因为提高了冰点
B.“会造成绿化植物死亡”是与盐析有关
C.“会造成土壤板结贫瘠”是与物质的分解吸热有关
D.“会加快路基上铁的腐蚀”是与形成原电池有关
(3)某公司生产的融雪剂由NaCl、NaNO3、AlCl3、CuSO4、K2CO3中的几种物质组成。某同学设计下列过程探究其组成:
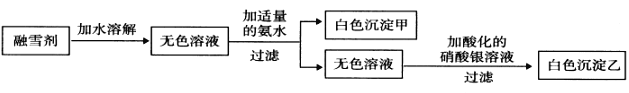
请回答下列问题:
①该融雪剂中一定不含的物质是_________________(填名称)。
②若取融雪剂样品a g,通过上述探究途径得白色沉淀乙bmol,则该融雪剂中含氯元素的质量分数为 ____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是( )
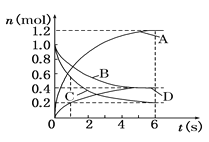
A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 反应进行到1 s时,v(A)=v(D)
C. 反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D. 反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.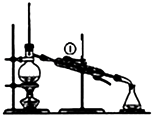 装置可用于实验室制取蒸馏水,从①处通入冷却水
装置可用于实验室制取蒸馏水,从①处通入冷却水
B.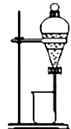 萃取操作时,所选萃取剂的密度必须要大于水的密度
萃取操作时,所选萃取剂的密度必须要大于水的密度
C.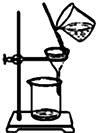 装置可用于除去固体BaCl2中的MgSO4
装置可用于除去固体BaCl2中的MgSO4
D.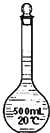 装置在配制一定物质的量浓度的溶液之前无需润洗
装置在配制一定物质的量浓度的溶液之前无需润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标况下,m g气体A与n g气体B的分子数目一样多,以下说法不正确的是( )
A.在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m:n
B.25℃,1.25×105 Pa时,两气体的密度之比为n:m
C.同质量的A,B在非标准状况下,其分子数之比为n:m
D.相同状况下,同体积的气体A与B的质量之比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:
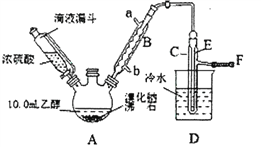
【题目】实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其实验的装置如下(反应需要加热,图中省去了加热装罝):
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/(g cm-3) | 0.79 | 1.44 | 3. 1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A装置的名称是________。
(2)沸石的作用是________。
(3)己知H2SO4(浓)+NaBr![]() NaHSO4+HBr↑,写出A中生成溴乙烷的化学方程式________。
NaHSO4+HBr↑,写出A中生成溴乙烷的化学方程式________。
(4)C中收集到的粗产品混有杂质的主要成份是________;为了除去这些杂质,最好选择下列____(选填序号)溶液来洗涤所得粗产品。
A.氢氧化钠B.碘化钠C.亚硫酸钠D.碳酸氢钠
(5)粗产品洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的M固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g。
①M固体的名称为________;
②在上述提纯过程中每次分液时,产品均从分液漏斗的________(填“上口”或“下口”)放出;
③从乙醇的角度考虑,本实验所得溴乙烷的产率是_________。
(6)该实验装罝的主要缺陷是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com