
【题目】Ⅰ.已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
(1)下列微粒可以大量共存的是________(填字母)。
a.CO![]() 、HSO
、HSO![]() b.HCO
b.HCO![]() 、HSO
、HSO![]()
c.SO![]() 、HCO
、HCO![]() d.H2SO3、HCO
d.H2SO3、HCO![]()
(2)已知NaHSO3溶液显酸性,解释原因:_____________________________;
NaHSO3的稀溶液中各离子浓度从大到小的排列顺序是_____________________________。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度从大到小的顺序为____________________________。
浓度从大到小的顺序为____________________________。
(4)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________________。
Ⅱ.Na2S2O5(焦亚硫酸钠)是常见的食品抗氧化剂之一。
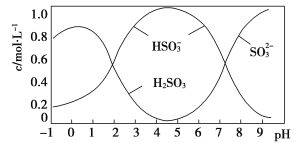
(5)将0.5 mol Na2S2O5溶于水配成1 L溶液,该溶液pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化情况如图所示。写出Na2S2O5溶于水的化学方程式:____________________________;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是________________________。pH=3时,溶液中主要含硫粒子浓度的大小关系为________。
(6)已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaSO3)=5.0×10-7。将部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO![]() 沉淀完全[c(SO
沉淀完全[c(SO![]() )≤1.0×10-5mol·L-1],此时溶液中c(SO
)≤1.0×10-5mol·L-1],此时溶液中c(SO![]() )≤________mol·L-1。
)≤________mol·L-1。
【答案】Ⅰ.(1)bc (2)HSO![]() 的电离程度大于水解程度
的电离程度大于水解程度
c(Na+)>c(HSO![]() )>c(H+)>c(SO
)>c(H+)>c(SO![]() )>c(OH-)
)>c(OH-)
(3)c(SO![]() )>c(CO
)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(HSO
)>c(HSO![]() )
)
(4)H2SO3+HCO![]() =HSO
=HSO![]() +CO2↑+H2O
+CO2↑+H2O
Ⅱ.(5)Na2S2O5+H2O=2NaHSO3 H2SO3分解产生SO2或H2SO3被氧化 HSO![]() 的浓度大于H2SO3的
的浓度大于H2SO3的
(6)0.05
【解析】Ⅰ.(1)已知Ka越大酸性越强,由于HCO![]() 的酸性小于HSO
的酸性小于HSO![]() 的酸性,所以HCO
的酸性,所以HCO![]() 与SO
与SO![]() 不反应,即bc能共存。(2)HSO
不反应,即bc能共存。(2)HSO![]() 的电离程度大于水解程度使得溶液显酸性;HSO
的电离程度大于水解程度使得溶液显酸性;HSO![]() 发生电离,c(Na+)>c(HSO
发生电离,c(Na+)>c(HSO![]() ),水也能电离出H+,因此c(H+)>c(SO
),水也能电离出H+,因此c(H+)>c(SO![]() ),由于溶液显酸性,电离大于水解,所以c(SO
),由于溶液显酸性,电离大于水解,所以c(SO![]() )>c(OH-),即c(Na+)>c(HSO
)>c(OH-),即c(Na+)>c(HSO![]() )>c(H+)>c(SO
)>c(H+)>c(SO![]() )>c(OH-)。(3)根据题给Ka可知,水解程度CO
)>c(OH-)。(3)根据题给Ka可知,水解程度CO![]() >SO
>SO![]() >HCO
>HCO![]() >HSO
>HSO![]() ,则溶液中离子浓度:c(SO
,则溶液中离子浓度:c(SO![]() )>c(CO
)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(HSO
)>c(HSO![]() )。(4)由题干数据可知H2SO3的二级电离常数小于H2CO3的一级电离常数,所以酸性H2SO3>H2CO3>HSO
)。(4)由题干数据可知H2SO3的二级电离常数小于H2CO3的一级电离常数,所以酸性H2SO3>H2CO3>HSO![]() ,所以反应的主要离子方程式为H2SO3+HCO
,所以反应的主要离子方程式为H2SO3+HCO![]() =HSO
=HSO![]() +CO2↑+H2O。Ⅱ.(5)据图可知,pH=4.5时,溶液中主要有亚硫酸氢根离子,所以Na2S2O5溶于水的化学方程式为Na2S2O5+H2O=2NaHSO3。当溶液pH小于1时,溶液中主要有亚硫酸存在,但亚硫酸不稳定,易分解生成二氧化硫,亚硫酸被氧化也会导致浓度变小。根据图示,pH=3时,HSO
+CO2↑+H2O。Ⅱ.(5)据图可知,pH=4.5时,溶液中主要有亚硫酸氢根离子,所以Na2S2O5溶于水的化学方程式为Na2S2O5+H2O=2NaHSO3。当溶液pH小于1时,溶液中主要有亚硫酸存在,但亚硫酸不稳定,易分解生成二氧化硫,亚硫酸被氧化也会导致浓度变小。根据图示,pH=3时,HSO![]() 的浓度大于H2SO3的。(6)根据Ksp(BaSO4)=c(Ba2+)·c(SO
的浓度大于H2SO3的。(6)根据Ksp(BaSO4)=c(Ba2+)·c(SO![]() ),可知需要c(Ba2+)=
),可知需要c(Ba2+)=![]() =
=![]() =1.0×10-5(mol·L-1),则溶液中SO
=1.0×10-5(mol·L-1),则溶液中SO![]() 的最大浓度c(SO
的最大浓度c(SO![]() )=
)=![]() =
=![]() =0.05 (mol·L-1)。
=0.05 (mol·L-1)。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图所示,a、b为惰性电极。利用该装置可将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的。下列说法不正确的是( )
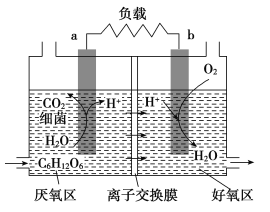
A.a为负极,电极反应式为:C6H12O6+6H2O-24e-=6CO2↑+24H+
B.反应过程中产生的质子透过离子交换膜扩散到好氧区
C.装置中的离子交换膜是阳离子交换膜
D.该装置可把电能转化为生物质能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性,充电时右槽溶液颜色由绿色变为紫色。下列叙述正确的是( )
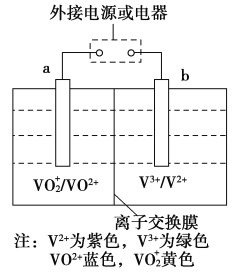
A.充电时,b极接直流电源正极,a极接直流电源负极
B.充电过程中,a极的电极反应式为:VO![]() +2H++e-=VO2++H2O
+2H++e-=VO2++H2O
C.放电时,H+从左槽迁移进右槽
D.放电过程中,左槽溶液颜色由黄色变为蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2、Fe2O3、Na2SO4溶液、Ba(OH)2溶液、盐酸五种物质,在常温下两种物质间能发生的化学反应有( )
A.3个
B.4个
C.5个
D.6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图。下列有关说法正确的是( )
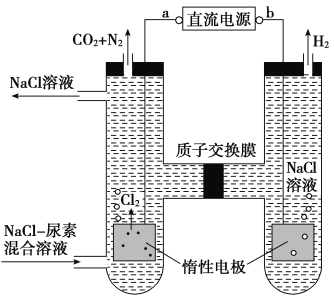
A.a为电源的负极
B.电解结束后,阴极室溶液的pH与电解前相比将升高
C.阳极室中发生的电极反应为2H++2e-=H2↑
D.若两极共收集到气体13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 冰镇的啤酒打开后泛起泡沫
B. 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
C. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
D. 黄绿色的氯水光照后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气燃烧的热化学方程式,可用下列两种方程式表示:
①2H2(g)+O2(g)=2H2O(l)+Q1kJ
②H2(g)+1/2O2(g)=H2O(g)+Q2kJ
Q1与Q2的关系为
A .Q1= Q2 B.Q2 >Q1 C.Q1>2Q2 D.Q1<2Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃的结构简式是CH3CH2CH2CH(CH2CH3)CH3,它的正确命名是
A. 3-甲基己烷 B. 2-乙基戊烷 C. 4-乙基戊烷 D. 2,2-二甲基戊烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com