
【题目】分析下列反应在任何温度下均能自发进行的是( )
A.2N2(g)+O2(g)═2N2O(g)△H=+163kJmol-1
B.Ag(s)+![]() Cl2(g)═AgCl(s)△H=-127kJmol-1
Cl2(g)═AgCl(s)△H=-127kJmol-1
C.HgO(s)═Hg(l)+![]() O2(g)△H=+91kJmol-1
O2(g)△H=+91kJmol-1
D.H2O2(l)═![]() O2(g)+H2O(l)△H=-98kJmol-1
O2(g)+H2O(l)△H=-98kJmol-1
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都是元素周期表中前四周期的元素,它们的核电荷数依次增大。其中
都是元素周期表中前四周期的元素,它们的核电荷数依次增大。其中![]() 与
与![]() 、
、![]() 与
与![]() 在周期表中相邻,
在周期表中相邻,![]() 原子核外有两个未成对电子,
原子核外有两个未成对电子,![]() 的第一电离能比同周期相邻两种元素的都大,
的第一电离能比同周期相邻两种元素的都大,![]() 原子在同周期元素原子中半径最大(稀有气体原子除外);
原子在同周期元素原子中半径最大(稀有气体原子除外);![]() 与
与![]() 位于不同周期,
位于不同周期,![]() 原子核外最外层电子数与
原子核外最外层电子数与![]() 相同,其余各电子层均充满电子。请根据以上信息,回答下列问题。
相同,其余各电子层均充满电子。请根据以上信息,回答下列问题。
(1)![]() 、
、![]() 、
、![]() 、
、![]() 四种元素的电负性由大到小的排列顺序为_________。
四种元素的电负性由大到小的排列顺序为_________。
(2)![]() 的氢化物的结构式为_________,其分子的空间构型为________。
的氢化物的结构式为_________,其分子的空间构型为________。
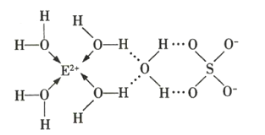
(3)![]() 的某种化合物的结构如图所示,已知微粒间的相互作用包括化学键和分子间作用力,则此化合物中各种粒子间的相互作用力有___________。
的某种化合物的结构如图所示,已知微粒间的相互作用包括化学键和分子间作用力,则此化合物中各种粒子间的相互作用力有___________。
(4)![]() 与
与![]() 的气态氢化物相比,_________(填化学式,下同)的沸点更高;
的气态氢化物相比,_________(填化学式,下同)的沸点更高;![]() 与
与![]() 的气态氢化物相比,________的沸点更高。
的气态氢化物相比,________的沸点更高。
(5)![]() 的稳定氧化物中,中心原子采取________杂化,该氧化物分子的空间构型为______。
的稳定氧化物中,中心原子采取________杂化,该氧化物分子的空间构型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取1mL 0.1mol·L-1AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1mol·L![]() ):
):
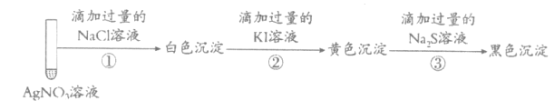
下列说法不正确的是
A.实验①白色沉淀是难溶的AgCl
B.由实验②说明AgI比AgCl更难溶
C.若按①③②顺序实验,看不到黑色沉淀
D.若按②①③顺序实验,看不到白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,向20.00mL 0.100 mol·L![]() HX中滴加0.100 mol·L
HX中滴加0.100 mol·L![]() NaOH过程中,pH变化如下图所示。
NaOH过程中,pH变化如下图所示。
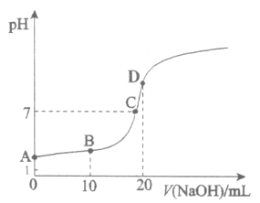
(1)写出HX的电离方程式:__________。
(2)下列有关B点溶液的说法正确的是__________(填字母序号)。
a. 溶质为:HX、NaX
b. 微粒浓度满足:c(Na+)+c(H+)=c(X-)+c(OH-)
c. 微粒浓度满足:c(Na+)=c(HX)+c(X-)
d. 微粒浓度满足:c(X-)>c(Na+)>c(H+)>c(OH-)
(3)A、C两点水的电离程度:A__________C(填“>”、“<”或“=”)。
(4)C点对应离子浓度由大到小的顺序为__________。
(5)用离子方程式解释D点溶液pH>7的原因:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb=3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。
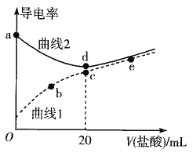
下列说法正确的是
A. 曲线1代表四甲基氢氧化铵溶液
B. 在b、c、e三点中,水的电离程度最大的点是e
C. b点溶液中存在c(H+)=c(OH-)+c(CH3NH2·H2O)
D. 常温下,CH3NH3Cl水解常数的数量级为10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:

回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示变化规律(p表示压强,T表示温度,n表示物质的量):
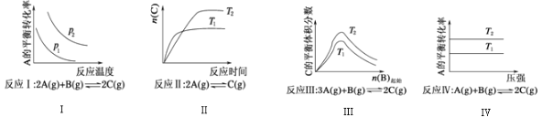
根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:△H>0,p2>p1
B.反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1
C.反应Ⅱ:△H>0,T1>T2
D.反应Ⅳ:△H<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.硫酸厂大量排放含SO2的尾气会对环境造成严重危害。
(1)工业上可利用废碱液(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,得到Na2SO3溶液,该反应的离子方程式为______。
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)2CO2(g)的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
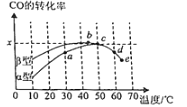
(2)a、b、c、d四点中,达到平衡状态的是______。
(3)已知c点时容器中O2浓度为0.02molL-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=______(用含x的代数式表示)。
(4)观察分析图,回答下列问题:

①CO转化反应的平衡常数K(a)______K(c)。
②在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要______(填“大”、“小”)。
③______点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、R、D都是周期表中前四周期的元素,它们的原子系数依次增大。其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素。
(1)写出基态D原子的电子排布式__________。
(2)已知高纯度R的单质在现代信息技术与新能源开发中具有极为重要的地位。工业上生产高纯度R的单质过程如下:
![]()
写出过程③的反应方程式___________,已知RHCl3的沸点是31.5oC,则该物质的晶体类型是__________,中心原子的轨道杂化类型为__________,该物质的空间构型是______。
(3)A的第一电离能比B的第一电离能大的原因是_________,A、B两元素分别与R形成的共价键中,极性较强的是________。A、B两元素间能形成多种二元化合物,其中与A3-互为等电子体的物质的化学式为_______。
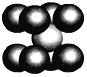
(4)已知D单质的晶胞如图所示,则晶体中D原子的配位数为______,一个D的晶胞质量为____,已知D原子半径为r pm,则该晶胞的空间利用率为_____________ (写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com