
【题目】惰性气体以性质稳定著称,但随着科学的发展,科学家们合成了一些氙的化合物。根据所学知识回答下列问题:
(1) Xe原子的核外电子排布式为________。稀有气体中只有氙能合成出多种化合物,其原因可能是_____ (填序号)。
A.氙含量比较丰富 B.氙原子半径大,电离能小 C.氙原子半径小,电离能大
(2) 研究报告指出:“关于XePtF6的化合价有![]() [
[![]() ]、
]、![]() [
[![]() ]两种可能,经证实XePtF6不溶于CC14等非极性溶剂。”据此可确定Xe[PtF6]中化学键类型为_____________。
]两种可能,经证实XePtF6不溶于CC14等非极性溶剂。”据此可确定Xe[PtF6]中化学键类型为_____________。
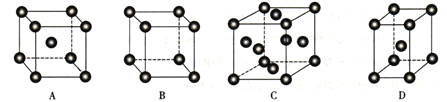
(3)金属Pt采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是__________ (填序号)。
(4)已知与铯同主族的前四周期(包括第四周期)的三种元素X、Y、Z的电离能如下表:
元素代号 | X | Y | Z |
第一电离能(kJ.mol-1) | 520 | 496 | 419 |
那么三种元素X、Y、Z的元素符号分别为__________,形成其单质晶体的化学键类型是____________。
(5)氟元素与碘元素同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,两者分子中的中心原子Be和O的杂化方式分别是___________、__________________。
(6)与碘同主族的氯具有较高的活泼性,能够形成大量的含氯化合物,如金属氯化物、非金属氯化物等。BC13是一种非金属氯化物,该物质分子中B-Cl键的键角为_____________。
【答案】 [Kr]4d105s25p6 B 离子键、配位键 C Li、Na、K 金属键 sp sp3 120°
【解析】(1)X位于第五周期的sp区,处于全满稳定状态,核外电子排布式为[Kr]4d105s25p6;氙原子半径大,电离能越小,越容易失去电子,化学性质越活泼,A、氙为稀有气体,含量比较少,A错误;B、氙原子半径大,电离能小,B正确;C、氙在稀有气体中原子半径较大,电离能较小,C错误,答案选B;(2)根据相似相溶原理,XePtF6不溶于CCl4等非极性溶剂,XePtF6具有较强的极性,其化学键类型为离子键和配位键;(3)金属Pt采用“…ABCABC…”型堆积方式,为立方面心结构,因此选C;(4)由铯的最外层电子排布式为6s1可知X、Y、Z为第ⅠA族,而ⅠA族前四周期的元素分别为H、Li、Na、K,又由提供的X、Y的第一电离能的差值与Y、Z的第一电离能的差值相差不大可知,X、Y、Z不可能有H元素,而同主族元素随着电子层数的增加,第一电离能逐渐减小,故X、Y、Z分别为Li、Na、K;都是金属单质,微粒均以金属键结合;(5)BeF2分子内中心原子为Be,其价电子数为2,F提供2个电子,所以Be原子的价层电子对数为(2+2)/2=2,Be原子的杂化类型为sp杂化;H2O分子的中心原子为O,其价电子数为6,H提供2个电子,所以O原子的价层电子对数为(6+2)/2=4,O原子杂化类型为sp3;(6)硼原子价电子数为3,Cl提供3个电子,硼原子的价层电子对数为(3+3)/2=3,因价层电子对中没有孤对电子,故BCl3为平面正三角形结构,分子中B-Cl键的键角为120°。


科目:高中化学 来源: 题型:
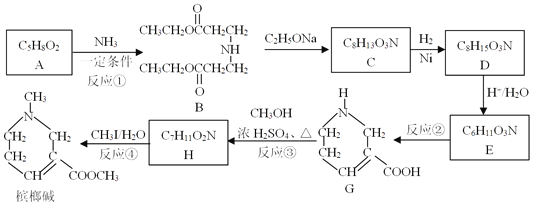
【题目】槟榔碱在医疗上常用于治疗青光眼,其一种合成路线如下:
已知:Ⅰ.不饱和化合物与氨(NH3)或胺(R—NH2)反应能生成新的胺类化合物
如:![]()
II.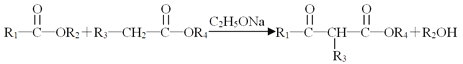
(1)B中含氧官能团的名称为______________。
(2)反应①的反应类型为____________;反应②的反应条件为______________。
(3)反应③的化学方程式为_____________________。
(4)C的结构简式为__________。
(5)下列说法正确的是____________(填字母)。
a.反应④为取代反应
b.槟榔碱与化合物G互为同系物
c.1 mol D最多能与2 mol NaOH发生反应
(6)已知A在NaOH溶液中水解的产物之一是一种新型功能高分子材料(PAANa)的单体,写出生成PAANa的化学方程式__________________________。
(7)已知:CH2=CHCH3 +Cl2 ![]() CH2=CHCH2Cl+HCl,以丙烯和乙醇为起始原料,选用必要的无机试剂合成A,写出合成路线____________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
CH2=CHCH2Cl+HCl,以丙烯和乙醇为起始原料,选用必要的无机试剂合成A,写出合成路线____________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产Na2S2O35H2O,原理是S+Na2SO3![]() Na2S2O3(Na2SO3稍过量)。实验室可用如下装置(略去部分加持仪器)模拟生成过程。
Na2S2O3(Na2SO3稍过量)。实验室可用如下装置(略去部分加持仪器)模拟生成过程。

(1)仪器A中产生气体的化学方程式为______________________。
(2)装置B的作用是________________________________________。
(3)实验中,为使SO2缓慢进入装置C,采用的操作是____________________,装置C中制备反应结束的现象是_________________________________。
(4)装置C中的溶液,一般控制在碱性环境,否则产品发黄,用离子反应方程式表示其原因________________________________________________;为减少装置C中常可能出现的Na2SO4杂质,在不改变原有装置的基础上应采取的操作是___________________;反应结束后,过滤C中的混合物,滤液经________(填写操作名称)、结晶、过滤、洗涤、干燥,得到产品。
(5)装置D用于处理尾气,可选用的最合理装置(夹持仪器已略去)为______(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是
A. 离子键没有方向性和饱和性,共价键有方向性和饱和性
B. 配位键在形成时,由成键双方各提供一个电子形成共用电子对
C. 金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
D. 金属键中的“自由电子”为金属阳离子共用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量.称取1.59g样品,溶于水配成250.00mL溶液,取出该溶液25.00mL用0.1molL﹣1盐酸进行滴定,得到如图曲线.以下说法或操作正确的是( )
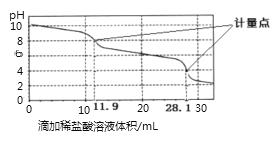
A. 上一个计量点前发生反应的离子方程式为HCO3﹣+H+═H2O+CO2↑
B. 下一个计量点溶液中存在大量的阴离子是Cl﹣、HCO3﹣
C. 此样品n(NaHCO3)=(28.1﹣2×11.9)×10﹣4 mol
D. 使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下图所示A、B、C、D四种仪器,写出名称:

A. ,B. ,
C. ,D. 。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,可使仪器不漏液或不漏气。在下列仪器中:①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶;⑦酸式滴定管;⑧碱式滴定管,肯定用不到“磨砂”处理的有 (填序号)。
(3)以下是中学化学实验中常见的定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平
①其中标有仪器使用温度的是 (填编号)。
②实验时用来精确量取液体体积的是 (填编号)。
③使用前要检查仪器是否漏液的是 (填编号)。
(4)玻璃棒的作用主要有以下四种:①搅拌、②引流、③蘸取溶液、④转移固体。不同实验中其作用可能不完全相同,请回答下列问题:
A.在“用无水碳酸钠配制100 mL 0.12 mol·L-1的碳酸钠溶液”的实验中,玻璃棒的作用是 (填写编号)。
B.在“用氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以制得纯净的食盐”的实验中玻璃棒的作用可能是 (填写编号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com