
【题目】工业上常利用含硫废水生产Na2S2O35H2O,原理是S+Na2SO3![]() Na2S2O3(Na2SO3稍过量)。实验室可用如下装置(略去部分加持仪器)模拟生成过程。
Na2S2O3(Na2SO3稍过量)。实验室可用如下装置(略去部分加持仪器)模拟生成过程。

(1)仪器A中产生气体的化学方程式为______________________。
(2)装置B的作用是________________________________________。
(3)实验中,为使SO2缓慢进入装置C,采用的操作是____________________,装置C中制备反应结束的现象是_________________________________。
(4)装置C中的溶液,一般控制在碱性环境,否则产品发黄,用离子反应方程式表示其原因________________________________________________;为减少装置C中常可能出现的Na2SO4杂质,在不改变原有装置的基础上应采取的操作是___________________;反应结束后,过滤C中的混合物,滤液经________(填写操作名称)、结晶、过滤、洗涤、干燥,得到产品。
(5)装置D用于处理尾气,可选用的最合理装置(夹持仪器已略去)为______(填序号)。

【答案】 Na2SO3+H2SO4==Na2SO4+SO2↑+H2O 缓冲装置(或者平衡装置内外压强等)、观察SO2生成速率 控制滴加硫酸的速度 溶液重新变为澄清 S2O32-+2H+==S↓+SO2↑+H2O 先通一段时间SO2后再打开加热装置 蒸发 d
【解析】试题分析:(1) 仪器A中亚硫酸钠与浓硫酸反应生成二氧化硫、硫酸钠、水;(2)装置B的作用是可以通过观察气泡,分析生成二氧化硫的速率,通过观察长颈漏斗内液面的变化判断装置内的压强变化;(3)实验中,可以通过控制滴加硫酸的速度使SO2缓慢进入装置C;C中发生如下3个反应,
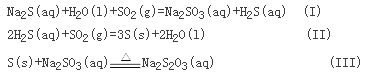 反应(III)相对较慢,而反应III是固体S与亚硫酸钠溶液反应所以烧瓶C中反应达到终点的现象是溶液变澄清。(4)Na2S2O3在酸性条件下不稳定,生成硫、二氧化硫;Na2SO3容易被氧气氧化为Na2SO4,为减少装置C中常可能出现的Na2SO4杂质,需要隔绝空气;溶液蒸发、结晶、过滤、洗涤、干燥可得产品;(5)尾气中含有二氧化硫,可以氢氧化钠等碱性溶液吸收,A装置。
反应(III)相对较慢,而反应III是固体S与亚硫酸钠溶液反应所以烧瓶C中反应达到终点的现象是溶液变澄清。(4)Na2S2O3在酸性条件下不稳定,生成硫、二氧化硫;Na2SO3容易被氧气氧化为Na2SO4,为减少装置C中常可能出现的Na2SO4杂质,需要隔绝空气;溶液蒸发、结晶、过滤、洗涤、干燥可得产品;(5)尾气中含有二氧化硫,可以氢氧化钠等碱性溶液吸收,A装置。
解析:根据以上分析,(1) 仪器A中亚硫酸钠与浓硫酸反应的方程式为Na2SO3+H2SO4==Na2SO4+SO2↑+H2O;
(2)装置B的作用是可以通过观察气泡,分析生成二氧化硫的速率,通过观察长颈漏斗内液面的变化判断装置内的压强变化,所以仪器B的作用是缓冲装置(或者平衡装置内外压强等)、观察SO2生成速率;
(3)实验中,可以通过控制滴加硫酸的速度使SO2缓慢进入装置C;
C中发生如下3个反应,
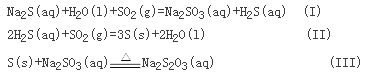
反应(III)相对较慢,而反应III是固体S与亚硫酸钠溶液反应,所以烧瓶C中反应达到终点的现象是溶液重新变澄清。(4)Na2S2O3在酸性条件下不稳定,生成硫、二氧化硫,方程式为S2O32-+2H+==S↓+SO2↑+H2O ;Na2SO3容易被氧气氧化为Na2SO4,为减少装置C中常可能出现的Na2SO4杂质,需要隔绝空气,方法是先通一段时间SO2后再打开加热装置;溶液蒸发可以获得晶体;(5)尾气中含有二氧化硫,可以氢氧化钠等碱性溶液吸收。A装置由于有橡胶塞,二氧化硫不能进入,故A错误;液体试剂不能放入U型管中,故B错误;二氧化硫难溶于硫酸,故C错误;二氧化硫易溶于氢氧化钠溶液,并且有防倒吸装置,故d正确。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】(1)Na+与Ne互为等电子体,电离能I2(Na)___I1(Ne)(填“<”、 “=”或“>”).
(2)第四周期中,与Al原子未成对电子数相同的金属元素有___种。气态氯化铝的分子组成为(AlCl3)2,分子中所含的化学键类型有_______,Al原子的杂化方式为____。

(3)可燃冰是天然气水合物,具有笼形结构如图A(表面的小球是水分子,内部的大球是甲烷分子)。水分子成笼的作用力是_________,图A中最小的环中连接的原子总数是_________。
可燃冰晶体具有多种笼状结构,其中一种由1个图A所示笼分别用2个面与另外两个相同的笼共面而成,则中间笼实际占有____________个水分子。
(4)金属镁晶体中原子的堆积方式为六方最密堆积如图B所示,晶胞可用图C表示。设金属镁的原子半径为a cm,晶胞的高为b cm,则该晶体的空间利用率为__________(写出计算式);设晶胞中A点原子的坐标为(0,0,0),C点原子的坐标为(2a,0,0),D点原子的坐标为(0,0,b),则B点原子的坐标为__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两种有机物不属于同分异构体的是( )
A.麦芽糖与蔗糖B.CH3CH2COOH和CH3OCH2CHO
C.淀粉和纤维素D.乙酸与甲酸甲酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)![]() 2HI(g) △H<0。反应中各物质的浓度随时间变化情况如图1:
2HI(g) △H<0。反应中各物质的浓度随时间变化情况如图1:

(1)根据图1数据,反应开始至达到平衡时,平均速率v(HI)=_____mol/(L·min),转化率α(H2)=____________________。
(2)HI的体积分数φ(HI)随时间变化如图2中曲线II所示。若改变反应条件下,在甲条件下φ(HI)的变化如图曲线(I)所示,在乙条件下φ(HI)的变化如图曲线(III)所示。则甲条件可能是____________(填入下列条件的序号。下同),乙条件可能是_______________。
① 恒容条件下,升高温度
② 恒容条件下,降低温度
③ 恒温条件下,缩小反应容器体积
④ 恒温条件下,扩大反应容器体积
⑤ 恒温恒容条件下,加入适当催化剂
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)在一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。现向浓度均为0.20mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4溶液,先生成______沉淀(填化学式);当测得溶液中一种金属阳离子沉淀完全(浓度小于10-5 mol·L-1)时,溶液中另一种金属阳离子的物质的量浓度c=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种碳骨架如下的烃。下列说法正确的是( )
![]()
①a和d是同分异构体 ②b和c是同系物 ③a和d都能发生加聚反应 ④只有b和c能发生取代反应
A. ①② B. ①④
C. ②③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】惰性气体以性质稳定著称,但随着科学的发展,科学家们合成了一些氙的化合物。根据所学知识回答下列问题:
(1) Xe原子的核外电子排布式为________。稀有气体中只有氙能合成出多种化合物,其原因可能是_____ (填序号)。
A.氙含量比较丰富 B.氙原子半径大,电离能小 C.氙原子半径小,电离能大
(2) 研究报告指出:“关于XePtF6的化合价有![]() [
[![]() ]、
]、![]() [
[![]() ]两种可能,经证实XePtF6不溶于CC14等非极性溶剂。”据此可确定Xe[PtF6]中化学键类型为_____________。
]两种可能,经证实XePtF6不溶于CC14等非极性溶剂。”据此可确定Xe[PtF6]中化学键类型为_____________。
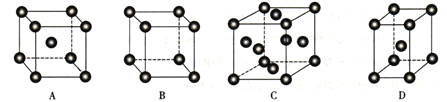
(3)金属Pt采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是__________ (填序号)。
(4)已知与铯同主族的前四周期(包括第四周期)的三种元素X、Y、Z的电离能如下表:
元素代号 | X | Y | Z |
第一电离能(kJ.mol-1) | 520 | 496 | 419 |
那么三种元素X、Y、Z的元素符号分别为__________,形成其单质晶体的化学键类型是____________。
(5)氟元素与碘元素同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,两者分子中的中心原子Be和O的杂化方式分别是___________、__________________。
(6)与碘同主族的氯具有较高的活泼性,能够形成大量的含氯化合物,如金属氯化物、非金属氯化物等。BC13是一种非金属氯化物,该物质分子中B-Cl键的键角为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠的叙述中,正确的是( )
A. 钠是银白色金属,硬度很大
B. 加热时,金属钠先熔成闪亮的小球并剧烈燃烧,产生黄色火焰,生成过氧化钠
C. 金属钠在空气中燃烧,生成氧化钠
D. 钠属于金属,所以熔点必然很高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验方法和结论正确的是 ( )
A. 加入硝酸银溶液有白色沉淀生成,证明原溶液中一定有Cl-
B. 在加入稀硝酸后的溶液中,再滴加氯化钡溶液有白色沉淀生成,证明原溶液中一定有SO![]()
C. 加入盐酸后加热,放出能使澄清石灰水变浑浊的无色无味气体,证明原溶液中一定含有CO![]()
D. 加入紫色石蕊试液,溶液显红色,证明溶液一定呈酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com