
【题目】下列叙述错误的是( )
A. 离子键没有方向性和饱和性,而共价键有方向性和饱和性
B. 离子键的强弱主要决定于离子半径和离子所带电荷数
C. 配位键在形成时,由成键双方各提供一个电子形成一对共用电子
D. 金属键的实质是金属中的自由电子与金属阳离子形成的一种强烈的相互作用
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】I、通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答。
(1)用化学符号表示下列微粒:C:________,D:_________。
(2)写出A、B、E三种微粒反应的离子方程式:______________________。
II、A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物的化学式为AE,其分子中含18个电子。请回答下列问题:
(1)D元素的原子结构示意图为___________________。
(2)由A、B、C三种元素形成的化合物的电子式为_________________,这种化合物中所含的化学键类型有___________________。
(3)A2B的沸点高于A2D,其原因是______________________。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是_________________(用离子方程式表示);将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,则该过程的总化学反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2C12)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示。常温下,S2C12是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2C12+2H2O=SO2↑+3S↓+4HCl。下列说法中错误的是
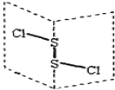
A.S2C12的结构式为Cl—S—S—Cl
B.反应中SO2是还原产物,S是氧化产物
C.S2C12为含有极性键和非极性键的分子
D.反应中,生成1molSO2,转移电子为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一块金属钠露置于空气中一段时间,为检验该固体是否部分变质为碳酸钠,先将固体样品溶解于水得到溶液,并采取下列措施,可以实现实验目的是( )
A.测所得溶液的pH
B.取溶液滴入酚酞观察是否变红
C.取溶液加入盐酸观察是否有气泡
D.取溶液加入CuSO4观察是否有沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有下列六种离子:①HCO3﹣②SO32﹣③Na+④CO32﹣⑤NH4+⑥NO3﹣,向其中加入一定量Na2O2后,溶液中离子浓度基本保持不变的是( )
A. 只有⑥ B. ④⑥ C. ③④⑥ D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中进行如下反应:2SO2(g)+O2(g)![]() 2SO3(g)。当SO2、O2、SO3的浓度不再改变时,下列说法正确的是
2SO3(g)。当SO2、O2、SO3的浓度不再改变时,下列说法正确的是
A.SO2、O2完全转化为SO3
B.正、逆反应速率相等且等于零
C.反应已达到化学平衡状态
D.SO2、O2、SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是
①SO2 ②CH3CH2CH=CH2③![]() ④CH3CH3
④CH3CH3
A. ①②③④ B. ③④ C. ①②④ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示。回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示。回答下列问题:

(1)降低温度,化学反应速度_________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是____ _____。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将氨水与氯化铵溶液混合得到 c(NH3·H2O)+c(NH4+) = 0.1mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列有关离子浓度关系叙述一定正确的是

A. W点表示溶液中:c(NH4+) +c(H+) =c(Cl-)+c(OH-)
B. pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1mol·L-1
C. pH=9.5溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+)
D. 向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(NH4+) >c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com