
【题目】断开1molH-H键、1molN-H键、1molN≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,求:生成1molNH3需要___(填“吸收”或“放出”)能量___kJ。
【答案】放出 46
【解析】
化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算,化学反应中,反应物的总能量大于生成物的总能量,反应放热,反之吸热,以此计算反应热并判断吸热还是放热。
拆1molH-H键、1molN≡N、1molN-H键分别需要吸收的能量为436kJ、946kJ、391kJ,在反应N2+3H2![]() 2NH3中,断裂3mol H-H键,1mol N≡N键共吸收的能量为:3×436kJ+946kJ=2254kJ;生成2mol NH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ;吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,所以生成1mol NH3放出热量为46kJ;故答案为:放出;46。
2NH3中,断裂3mol H-H键,1mol N≡N键共吸收的能量为:3×436kJ+946kJ=2254kJ;生成2mol NH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ;吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,所以生成1mol NH3放出热量为46kJ;故答案为:放出;46。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 甲苯可以与液溴混合后加入铁粉生成![]()
B. 实验室制备乙烯时,温度计水银球应该插入浓硫酸和无水乙醇的混合液液面以下
C. 向溴乙烷中加入NaOH溶液加热,充分反应,再加入AgNO3溶液,产生淡黄色沉淀,证明溴乙烷中含有溴元素
D. 制备新制Cu(OH)2悬浊液时,将4~6滴2%的NaOH溶液滴入2mL2%的CuSO4溶液中,边滴边振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所示实验,现象和结论均正确的是
选项 | 实验 | 现象 | 结论 |
A | 向浓度均为0.lmol/LNaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 常温下,测定等物质的量浓度的 Na2CO3和Na2SO3溶液的pH值 | 前者的pH值比后者的大 | 非金属性:S>C |
C | 向某溶液中加入硝酸酸化的氯化钡溶液 | 溶液中有白色沉淀生成 | 该溶液中含有SO42- |
D | 向FeCl3和KSCN混合溶液中,加入少量KC1固体 | 溶液颜色变浅 | FeCl3+3KSCN |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法不正确的是( )
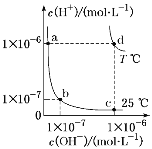
A. d点对应的食盐水pH=6,呈中性
B. 向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-)
C. a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
D. 温度为T ℃时,0.05 mol·L-1Ba(OH)2溶液的pH=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,它们都可看作化学平衡。请根据所学知识回答下列问题:
(1)AlCl3溶液呈______性(填“酸”“中”“碱”)原因是_________________________(用离子方程式表示);若把AlCl3溶液蒸干,灼烧,最后主要得到固体产物是________;若将AlCl3溶液和NaHCO3溶液混合,该反应的离子方程式为__________________________________________。
(2)将1L0.2 mol·L-1HA溶液与1L0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则:
①混合溶液中,c(A-)________c(HA)(填“>”“<”或“=”,下同)。
②混合溶液中,c(HA)+c(A-)________0.1 mol·L-1。
(3)常温下,若NaOH溶液中c(OH—)与NH4Cl溶液中c(H+)相同,现将NaOH溶液和NH4Cl溶液分别稀释10倍,稀释后NaOH溶液和NH4CI溶液的pH分别用pH1和pH2表示。则pH1 +pH2________(填“>”“<”或“=”)14。
(4)pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、E四种常见物质含有同一种元素,其中E是一种强酸,在一定条件下,它们有如图所示转化关系。下列推断不合理的是

A. X可能是一种氢化物
B. Y可能直接转化为E
C. Y不可能转化为X
D. 若X是单质,则X转化为Y的反应可能是化合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )
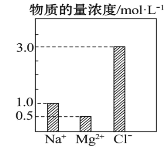
A.NaCl的物质的量为0.1mol
B.溶质MgCl2的质量为4.75g
C.该混合液中BaCl2的物质的量为0.1mol
D.将该混合液加水稀释至体积为1L,稀释后溶液中的Na+物质的量的浓度为0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24L Cl2溶于水或NaOH溶液中转移的电子数均为0.1NA
B. 常温常压下,18g H2O含有的氢原子总数为NA
C. 2.3g钠在足量的氧气中燃烧,转移的电子数为0.1NA
D. 0.1mol CH3OH中所含C-H键的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请写出下列反应的离子方程式:
(1)NaOH与HCl反应:________________
(2)Zn与稀H2SO4反应:________________
(3)Na2SO4与BaCl2反应:________________
(4)CaCO3与稀HCl反应:________________
(5)CuSO4与Fe反应:________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com