
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。提示:黄緑色气体乙是氯气。

请回答下列问题:
(1)写出下列物质的化学式:B______,丙______,H______。
(2)根据要求回答:
①D溶液和F溶液在空气中混合的现象:_______;
②反应③离子方程式________;
③反应⑦离子方程式________;
④反应⑥化学方程式________。
【答案】Al HCl Fe(OH)2 产生白色沉淀迅速变成灰绿色,最后变为红褐色 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Fe2++2Cl2=2Cl-+2Fe3+ 4Fe(OH)2+ O2+2H2O=4Fe(OH)3
【解析】
金属单质A焰色反应为黄色证明为A是Na,与水反应生成气体甲为H2,物质D为NaOH;金属B和氢氧化钠溶液反应,说明B为Al,黄绿色气体乙为Cl2,气体甲和氯气反应生成丙为HCl,物质E为盐酸,物质D是氢氧化钠,D和物质G为反应H在空气中生成红褐色沉淀I为Fe(OH)3,则H是Fe(OH)2,Fe(OH)3与盐酸发生产生的G为FeCl3,物质F为FeCl2,可判断C为Fe,以此解答该题。
由以上推断可知A是Na,B是Al,C是Fe,D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)2,I是Fe(OH)3。
(1)根据上述分析可知B为Al,丙为HCl,H为Fe(OH)2;
(2)①D是NaOH,F是FeCl2,二者发生复分解反应生成氢氧化亚铁白色沉淀,氢氧化亚铁不稳定,易被空气中的氧气氧化生成红褐色的氢氧化铁沉淀,因此在空气中混合的现象为:产生白色沉淀,白色沉淀迅速变成灰绿色,最后变为红褐色;
②反应③是Al与NaOH溶液反应产生NaAlO2和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
③FeCl2具有还原性,Cl2具有强的氧化性,二者发生氧化还原反应产生FeCl3,所以反应⑦离子方程式为2Fe2++2Cl2=2Cl-+2Fe3+;
④Fe(OH)2不稳定,容易被氧气氧化产生Fe(OH)3,所以反应⑥化学方程式为4Fe(OH)2+ O2+2H2O=4Fe(OH)3。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】据报道,近年来发现了一种新的星际分子,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子)。
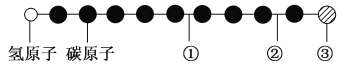
下列对该物质的说法中正确的是
A. ①处的化学键表示碳碳双键 B. ②处的化学键表示碳碳单键
C. ③处的原子可能是氯原子或氟原子 D. 此星际分子属于烃类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶炼金属铝的废弃物铝灰为原料制取超细![]() -氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
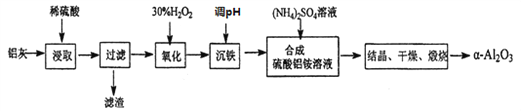
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为____(填选项编号)。

(2)流程中加入H2O2 有气体产生,原因是_______________________________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3。己知:
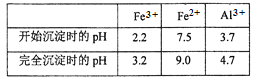
为保证产品的纯度,可以选用下列物质中的_______调节溶液pH(填字母),调节pH的范围为___________________________。
a.A12O3 b.NaOH c.Al(OH) 3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4 Al(SO4)2·12H2O] ![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
将产生的气体通过下图所示的装置:
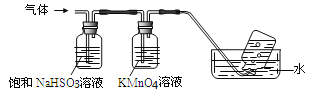
①集气瓶中收集到的气体是_____________________(填化学式);
②装有KMnO4溶液洗气瓶的作用是__________________________________;
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的操作正确的是
实验目的 | 实验操作 | |
A | 配制浓度为0.010 | 用托盘天平称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
B | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
C | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
D | 排水法收集KMnO4分解产生的O2 | 先移出导管,后熄灭酒精灯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与金属铜发生反应的化学方程式:______________________。
(2)某工程师为了从使用过的腐蚀废液(主要含CuCl2、FeCl3溶液等)中回收铜,并重新获得纯净的FeCl3溶液,准备采用如图所示流程:(已知:加过量①为Fe;加过量④为稀盐酸;通入⑥为Cl2)
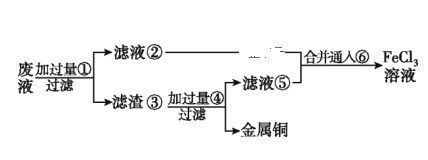
①上述实验中滤渣③的主要物质为___________________(填化学式),写出向②⑤的合并液中通入⑥的离子方程式:______________________________。
②配制并保存FeCl2溶液时,需加入铁屑,其目的是_______________________________。
③要证明FeCl3溶液是否含有Fe2+,可选择下列选项中的______________(已知:加入该物质后,生成蓝色沉淀)。
A.加入 K3[Fe(CN)6]溶液 B.加入NaOH溶液 C.加入KSCN溶液
(3)现有1.2 L含3 mol FeCl2的酸性溶液恰好与0.6 mol HIO3完全反应,还原产物为_______(填化学式,已知该物质遇淀粉溶液变蓝),该反应离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红钠矾(重铬酸钠: Na2Cr2O72H2O )是重要的基础化工原料,易溶于水,有强氧化性 ,极毒。2012 年中国科学院研究所发明了以铬酸钡为中间体,由铭酸钾制备高纯度重铬酸钠的方法。该方法的转化条件温和,污染物排放少,流程如下所示。
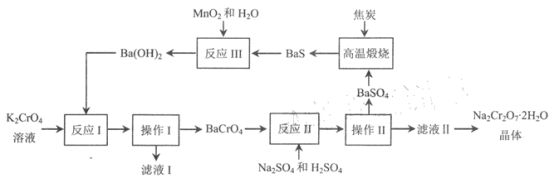
回答下列问题:
(1)操作I和操作II的名称均是 ____________, 滤液 I中溶质的主要成分的化学式为_____________。
(2)反应I、II、III中属于氧化还原反应的是____________________。
(3)高温煅烧时需加入过量焦炭,发生反应的化学方程式为 ________________.
(4)从平衡角度分析,反应 II 加H2SO4调节 pH 的原因是_______________(用离子方程式表示); 反应 II 不能用 HCl 替代H2SO4 的原因是_________________。
(5)含Cr2O72- 的废水需经化学处理,使其浓度降至符合国家有关标准方可排放。通常可在酸性废水中先加入适量绿矾(FeSO47H2O ) ,将Cr2O72- 还原成Cr3+,发生反应的离子方程式为___________, 再加入过量的石灰水,使 Cr3+转变为Cr(OH)3沉淀。用该方法处理 c(Cr2O72-) =1.5×10-3 mol·L-1的废水 10 m3,至少需要绿矾______kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
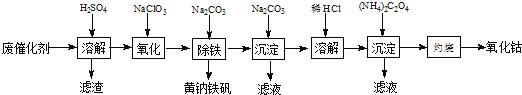
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是_________________,所得滤渣的主要成分是_________(写化学式)。
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式_________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]3H2O.
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是______________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式______________。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)23Co(OH)2],沉淀需洗涤,洗涤的操作是______________。
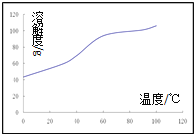
(5)溶解:CoCl2的溶解度曲线如图所示向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是______________。
(6)灼烧:准确称取所得CoC2O41.470g,在空气中充分灼烧得0.830g氧化钴,写出氧化钴的化学式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com