
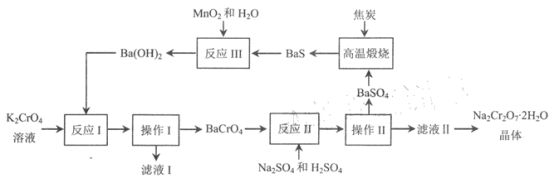
【题目】红钠矾(重铬酸钠: Na2Cr2O72H2O )是重要的基础化工原料,易溶于水,有强氧化性 ,极毒。2012 年中国科学院研究所发明了以铬酸钡为中间体,由铭酸钾制备高纯度重铬酸钠的方法。该方法的转化条件温和,污染物排放少,流程如下所示。
回答下列问题:
(1)操作I和操作II的名称均是 ____________, 滤液 I中溶质的主要成分的化学式为_____________。
(2)反应I、II、III中属于氧化还原反应的是____________________。
(3)高温煅烧时需加入过量焦炭,发生反应的化学方程式为 ________________.
(4)从平衡角度分析,反应 II 加H2SO4调节 pH 的原因是_______________(用离子方程式表示); 反应 II 不能用 HCl 替代H2SO4 的原因是_________________。
(5)含Cr2O72- 的废水需经化学处理,使其浓度降至符合国家有关标准方可排放。通常可在酸性废水中先加入适量绿矾(FeSO47H2O ) ,将Cr2O72- 还原成Cr3+,发生反应的离子方程式为___________, 再加入过量的石灰水,使 Cr3+转变为Cr(OH)3沉淀。用该方法处理 c(Cr2O72-) =1.5×10-3 mol·L-1的废水 10 m3,至少需要绿矾______kg。
【答案】过滤 KOH III BaSO4+4C ![]() BaS+4CO↑ 2CrO42-+2H+
BaS+4CO↑ 2CrO42-+2H+![]() Cr2O72-+H2O HCl易将Cr2O72- 还原为 Cr3+ (合理即可) 6Fe2++ Cr2O72-+ 14H+=6Fe 3++2 Cr3++7H2O 25.02
Cr2O72-+H2O HCl易将Cr2O72- 还原为 Cr3+ (合理即可) 6Fe2++ Cr2O72-+ 14H+=6Fe 3++2 Cr3++7H2O 25.02
【解析】
根据流程图分析知,K2CrO4溶液中加入Ba(OH)2反应I为:K2CrO4+ Ba(OH)2= BaCrO4↓+KOH,操作I为过滤,滤液I中主要化学成分为KOH;滤渣BaCrO4与硫酸钠发生反应II:BaCrO4+Na2SO4= BaSO4↓+ Na2CrO4,加入硫酸溶液调节pH,目的是使反应生成的铬酸根转化为重铬酸根,离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O;操作II为过滤,分离出滤渣BaSO4,滤液II的主要成分为Na2Cr2O7,结晶后得到高纯度Na2Cr2O72H2O晶体;硫酸钡沉淀与焦炭高温煅烧得到BaS,反应为BaSO4+4C
Cr2O72-+H2O;操作II为过滤,分离出滤渣BaSO4,滤液II的主要成分为Na2Cr2O7,结晶后得到高纯度Na2Cr2O72H2O晶体;硫酸钡沉淀与焦炭高温煅烧得到BaS,反应为BaSO4+4C ![]() BaS+4CO↑;BaS经反应III制备Ba(OH)2,反应为:BaS+MnO2+H2O=MnO+S+Ba(OH)2,MnO被氧化后生成MnO2可循环利用。
BaS+4CO↑;BaS经反应III制备Ba(OH)2,反应为:BaS+MnO2+H2O=MnO+S+Ba(OH)2,MnO被氧化后生成MnO2可循环利用。
(1)根据上述分析,反应I和反应II分别生成BaCrO4沉淀和BaSO4沉淀,所以操作I和操作II目的是分离出沉淀,操作名称为过滤;滤液I中溶质的主要成分的化学式为KOH,故答案为:过滤;KOH;
(2)反应I、II为复分解反应,反应III中S2-被MnO2氧化,所以属于氧化还原反应的是反应III,故答案为:III;
(3)高温煅烧时需加入过量焦炭,BaSO4被焦炭还原生成BaS,C被氧化生成CO,反应的化学方程式为 BaSO4+4C ![]() BaS+4CO↑,故答案为:BaSO4+4C
BaS+4CO↑,故答案为:BaSO4+4C ![]() BaS+4CO↑;
BaS+4CO↑;
(4)反应II中加H2SO4调节pH,目的是使反应生成的铬酸根转化为重铬酸根,离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O;反应II不能用 HCl 替代H2SO4 的原因是HCl易将Cr2O72- 还原为 Cr3+,故答案为:2CrO42-+2H+
Cr2O72-+H2O;反应II不能用 HCl 替代H2SO4 的原因是HCl易将Cr2O72- 还原为 Cr3+,故答案为:2CrO42-+2H+![]() Cr2O72-+H2O;HCl易将Cr2O72- 还原为 Cr3+;
Cr2O72-+H2O;HCl易将Cr2O72- 还原为 Cr3+;
(5) Fe2+将Cr2O72-还原成Cr3+,本身被氧化为Fe3+,根据电子转移守恒及电荷守恒进行缺项配平得到反应的离子方程式为6Fe2++ Cr2O72-+ 14H+=6Fe 3++2 Cr3++7H2O;根据上述反应得到关系:6Fe2+~Cr2O72-,则n(FeSO47H2O)=6n(Cr2O72-)=6×1.5×10-3/span>mol·L-1×10×103L=90mol,则m(FeSO47H2O)=278g/mol×90mol=25.02 kg,故答案为:6Fe2++ Cr2O72-+ 14H+=6Fe 3++2 Cr3++7H2O;25.02。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得:2KClO3+H2C2O4+H2SO4===2ClO2↑+2CO2↑+K2SO4+2H2O。下列有关该反应的说法正确的是( )
A. KClO3在反应中失去电子B. ClO2是还原产物
C. H2C2O4在反应中被还原D. 1 mol H2C2O4参加反应有4 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。提示:黄緑色气体乙是氯气。

请回答下列问题:
(1)写出下列物质的化学式:B______,丙______,H______。
(2)根据要求回答:
①D溶液和F溶液在空气中混合的现象:_______;
②反应③离子方程式________;
③反应⑦离子方程式________;
④反应⑥化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.某兴趣小组采用10.0 g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾[KAl(SO4)2·12H2O]的实验流程如图:

(1)试剂①应选用________(填字母)。
a.盐酸 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为__________________________。
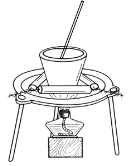
(3)从溶液C中得到明矾的实验操作为________、________、过滤,如用图所示装置进行该操作,其中的一处主要错误是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学在学习了电化学相关知识后,用如图装置进行实验,请回答下列问题:

(1)实验一:将开关K与a连接,则乙为_____极,电极反应式为______。
(2)实验一结束后,该研究小组的同学决定在乙电极表面上镀下列金属中的一种以防止铁被腐蚀,正确的选择是____(填字母编号)。
A.Cu B.Zn C.Sn D.Ag
(3)实验二:开关K与b连接,则乙__极,总反应的离子方程式为______。
(4)对于实验二,下列说法正确的是____(填字母编号)。
A.溶液中Na+向甲极移动
B.从甲极处逸出的气体能使湿润的淀粉-KI试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.反应在结束后,甲电极和乙电极上收集到的气体体积一定相等
(5)该研究小组的同学在进行实验二结束的溶液中滴加酚酞溶液,发现________(填“甲”或“乙”)极附近变红。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是( )
A.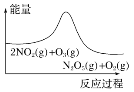 平衡后降温,NO2含量降低
平衡后降温,NO2含量降低
B.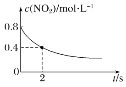 0~2 s内,υ(O3)=0.2 mol·L-1·s-1
0~2 s内,υ(O3)=0.2 mol·L-1·s-1
C.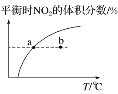 υ正:b点<a点,b点:υ逆<υ正
υ正:b点<a点,b点:υ逆<υ正
D.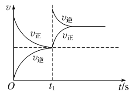 恒温,t1时再充入O3
恒温,t1时再充入O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为 1.0 L 的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
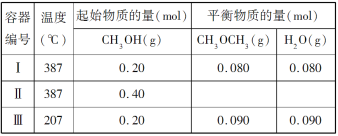
下列说法正确的是( )
A.该反应的正反应为吸热反应
B.达到平衡时,容器Ⅰ中的 CH3OH 体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入 CH3OH 0.15 mol、CH3OCH3 0.15 mol 和 H2O 0.10 mol,则反应将 向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将充满NO2和O2的试管倒立于水槽中,充分反应后,剩余气体的体积为原混合气体体积的![]() ,则原混合气体中NO2和O2的体积之比是
,则原混合气体中NO2和O2的体积之比是
A.8:1B.7:3C.1:7D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是_______、_______。
(2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是_______。
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过_______mL。
(4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到_______克固体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com