
【题目】一定温度下,在三个体积均为 1.0 L 的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
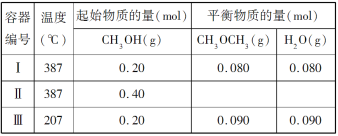
下列说法正确的是( )
A.该反应的正反应为吸热反应
B.达到平衡时,容器Ⅰ中的 CH3OH 体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入 CH3OH 0.15 mol、CH3OCH3 0.15 mol 和 H2O 0.10 mol,则反应将 向正反应方向进行
【答案】D
【解析】
A. 容器I和容器III中CH3OH起始物质的量相等,容器Ⅰ的温度高于容器III,达到平衡时容器I中生成物的物质的量小于容器III中,说明降低温度,平衡向正反应方向移动,则正反应是放热反应,故A错误;
B. 恒容条件下,容器Ⅱ相当于在容器Ⅰ的基础上加压,但由于该反应是反应前后气体体积不变的反应,因此平衡不移动,所以容器Ⅰ中的CH3OH体积分数和容器Ⅱ中的相等,故B错误;
C. 容器Ⅰ中的温度比容器III的温度高,温度越高反应速率越快,达到平衡所需时间越短,故C错误;
D. 容器Ⅰ中平衡时c(CH3OCH3)=c(H2O)=![]() =0.080mol/L, c(CH3OH)=
=0.080mol/L, c(CH3OH)=![]() =0.04mol/L,容器Ⅰ中化学平衡常数K=
=0.04mol/L,容器Ⅰ中化学平衡常数K=![]() =4,若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH30.15 mol和H2O 0.10 mol, 则起始浓度c(CH3OH)=0.15mol/L、c(CH3OCH3)=0.15mol/L、c(H2O)=0.10mol/L,浓度商Qc=
=4,若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH30.15 mol和H2O 0.10 mol, 则起始浓度c(CH3OH)=0.15mol/L、c(CH3OCH3)=0.15mol/L、c(H2O)=0.10mol/L,浓度商Qc=![]() =0.67<4,平衡向正反应方向进行,故D正确;
=0.67<4,平衡向正反应方向进行,故D正确;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与金属铜发生反应的化学方程式:______________________。
(2)某工程师为了从使用过的腐蚀废液(主要含CuCl2、FeCl3溶液等)中回收铜,并重新获得纯净的FeCl3溶液,准备采用如图所示流程:(已知:加过量①为Fe;加过量④为稀盐酸;通入⑥为Cl2)
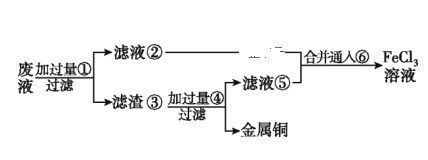
①上述实验中滤渣③的主要物质为___________________(填化学式),写出向②⑤的合并液中通入⑥的离子方程式:______________________________。
②配制并保存FeCl2溶液时,需加入铁屑,其目的是_______________________________。
③要证明FeCl3溶液是否含有Fe2+,可选择下列选项中的______________(已知:加入该物质后,生成蓝色沉淀)。
A.加入 K3[Fe(CN)6]溶液 B.加入NaOH溶液 C.加入KSCN溶液
(3)现有1.2 L含3 mol FeCl2的酸性溶液恰好与0.6 mol HIO3完全反应,还原产物为_______(填化学式,已知该物质遇淀粉溶液变蓝),该反应离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红钠矾(重铬酸钠: Na2Cr2O72H2O )是重要的基础化工原料,易溶于水,有强氧化性 ,极毒。2012 年中国科学院研究所发明了以铬酸钡为中间体,由铭酸钾制备高纯度重铬酸钠的方法。该方法的转化条件温和,污染物排放少,流程如下所示。
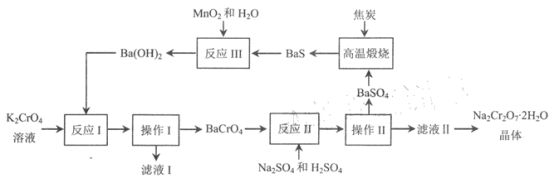
回答下列问题:
(1)操作I和操作II的名称均是 ____________, 滤液 I中溶质的主要成分的化学式为_____________。
(2)反应I、II、III中属于氧化还原反应的是____________________。
(3)高温煅烧时需加入过量焦炭,发生反应的化学方程式为 ________________.
(4)从平衡角度分析,反应 II 加H2SO4调节 pH 的原因是_______________(用离子方程式表示); 反应 II 不能用 HCl 替代H2SO4 的原因是_________________。
(5)含Cr2O72- 的废水需经化学处理,使其浓度降至符合国家有关标准方可排放。通常可在酸性废水中先加入适量绿矾(FeSO47H2O ) ,将Cr2O72- 还原成Cr3+,发生反应的离子方程式为___________, 再加入过量的石灰水,使 Cr3+转变为Cr(OH)3沉淀。用该方法处理 c(Cr2O72-) =1.5×10-3 mol·L-1的废水 10 m3,至少需要绿矾______kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中。回答下列问题:
(1)基态碳原子核外有________种能量不同的电子, 其核外电子运动状态由_____ 种因素决定。
(2)CH4分子间不能形成氢键, 主要原因是CH4 分子中的碳原子不含孤对电子、_____ 、 _____________。
(3)碳酸的非羟基氧的个数和磷酸的非羟基氧的个数都是1, 从结构上分析,它们的强度 相近,均为中强酸。然而事实上二氧化碳水溶液的酸性却很弱,原因是__________。
(4)乙二胺(H2NCH2CH2NH2)是 一种有机化合物, N 原子的杂化轨道类型为______,乙二胺通过配位键能与Cu2+ 形成稳定的环状配离子,其结构可表示为__________。
(5)金刚石是碳的一种同素异形体,属于_______ 晶体。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A 所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是下图 ___________(从 A~D 图中选填).
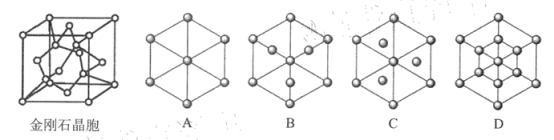
若碳原子半径为r ,金刚石晶胞中碳原子的空间占有率为_____________( 用含π 的代数.式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示方法不能完成相应实验的是
A.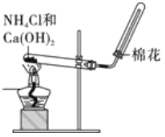 实验室制取并收集NH3
实验室制取并收集NH3
B.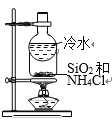 分离SiO2和NH4Cl
分离SiO2和NH4Cl
C. 检验草酸晶体中是否含有结晶水
检验草酸晶体中是否含有结晶水
D.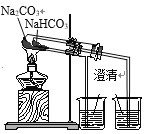 验证热稳定性:Na2CO3>NaHCO3
验证热稳定性:Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
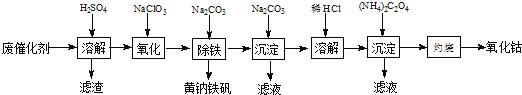
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是_________________,所得滤渣的主要成分是_________(写化学式)。
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式_________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]3H2O.
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是______________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式______________。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)23Co(OH)2],沉淀需洗涤,洗涤的操作是______________。
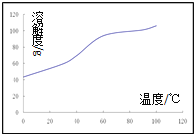
(5)溶解:CoCl2的溶解度曲线如图所示向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是______________。
(6)灼烧:准确称取所得CoC2O41.470g,在空气中充分灼烧得0.830g氧化钴,写出氧化钴的化学式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________________。
(2)反应Ⅲ能够自发进行的条件是_______________(填“较低温度” “较高温度”或“任何温度” )。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是______。
A.混合气体的密度不再变化 B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是__________。

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250 ℃时,随温度升高甲醇的产率增大
C.M 点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)已知下列物质在20℃下的Ksp如下,试回答下列问题:
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 货色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 2.0×10-12 |
①20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓由大到小的顺序是____________。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时c(Br-)/c(Cl-)=________________。
③ 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是____。
A.KBr B.KI C.K2S D.K2CrO4
(6)已知25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。
①在25℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成______________沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中___________(填“还含有”或“不含有”)Al(OH)3,并请写出计算过程。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com