
【题目】同一主族的X,Y,Z三种元素,已知其最高价含氧酸的钠盐溶液,等物质的量浓度时,溶液的pH大小为![]() ,则下列推断正确的是
,则下列推断正确的是
A.元素的非金属性强弱![]() B.相对原子质量
B.相对原子质量![]()
C.阴离子的还原性![]() D.气态氢化物稳定性
D.气态氢化物稳定性![]()
【答案】C
【解析】
三种元素最高价含氧酸的钠盐溶液,等物质的量浓度时,溶液的pH值越大,说明酸根离子的水解程度越大,对应酸的酸性越弱,则元素的非金属性越弱,因此X、Y、Z三种元素非金属性由强到弱为![]() ,同主族从上至下非金属性逐渐减弱,金属性越强,其阴离子的还原性越弱,气态氢化物越稳定,据此解答。
,同主族从上至下非金属性逐渐减弱,金属性越强,其阴离子的还原性越弱,气态氢化物越稳定,据此解答。
三种元素最高价含氧酸的钠盐溶液,等物质的量浓度时,溶液的pH值越大,说明酸根离子的水解程度越大,对应酸的酸性越弱,则元素的非金属性越弱,因此X、Y、Z三种元素非金属性由强到弱为![]() ;
;
A. 元素的非金属性强弱:![]() ,A项错误;
,A项错误;
B. 同一主族从上到下元素的非金属性逐渐减弱,非金属性强弱为![]() ,则从上到下分别为Z、Y、X,从上到下相对原子质量逐渐增加,因此相对原子质量
,则从上到下分别为Z、Y、X,从上到下相对原子质量逐渐增加,因此相对原子质量![]() ,B项错误;
,B项错误;
C. 元素的非金属性越强,对应阴离子的还原性越弱,因此阴离子的还原性![]() ,C项正确;
,C项正确;
D. 元素的非金属性越强,对应气态氢化物的稳定性越强,非金属性:![]() ,则气态氢化物的稳定性:
,则气态氢化物的稳定性:![]() ,D项错误。
,D项错误。
答案选C。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下:

下列说法不正确的是
A.Na2CO3溶液中存在水解平衡:![]() +H2O
+H2O![]() +OH-
+OH-
B.对比Ⅰ、Ⅲ,推测Na2CO3溶液能破坏铝表面的氧化膜
C.Ⅳ溶液中可能存在大量Al3+
D.推测出现白色浑浊的可能原因:![]() +
+![]() +H2O=Al(OH)3↓+
+H2O=Al(OH)3↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t ℃时AgCl的Ksp=4×10-10,在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
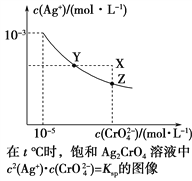
A. 在t ℃时,Ag2CrO4的Ksp为1×10-11
B. 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点
C. 在t ℃,Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)平衡常数K=6.25×107
(aq)平衡常数K=6.25×107
D. 在t ℃时,以0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用千冶金染料、皮革等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是( )
Na2S+2CO2↑。下列有关说法正确的是( )
A.12g石墨晶体中含有碳碳键的数目为3NA
B.1L0.1molL-1Na2S溶液中含阴离子的数目小于0.lNA
C.生成1mol氧化产物时转移电子数为4NA
D.常温常压下,11.2LCO2中含质子的数目为11NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:
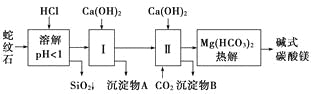
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是__________________。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)。
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.5 | 3.3 | 9.4 |
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入______________________________________________________________(填入物质的化学式),
然后______________________________________________________________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是________(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③________________________________________________________________________
④________________________________________________________________________
⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:
a=________,b=________,c=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化石燃料及其使用的一些说法中不正确的是( )
A. 煤的气化是指将固态煤粉碎后高温下变为气态,以使煤燃烧时能与氧气充分接触而完全燃烧
B. 天然气除可用作清洁能源外,也可用于合成氨和生产甲醇等
C. 石油分馏得到的汽油和石油催化裂化得到的汽油其成分不相同
D. 化石燃料也是重要的化工原料,乙烯和苯就是分别来自于石油和煤的基本化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究 Mg 与 NaHCO3 溶液反应的机理,做了如下探究。
实验一:
实验 A | 实验 B | |
操作 | 在注射器中加入过量镁片(擦去表面氧化膜), 吸入 15mL 饱和 NaHCO3 溶液。 | 在注射器中加入过量镁片(擦去表面 氧化膜),吸入 15mL 蒸馏水。 |
现象 | 有气体产生,20min 后注射器内壁和底部产生 大量白色沉淀 | 缓慢产生气体 |
(1)写出 B 中生成气体的化学方程式_____。
实验二:
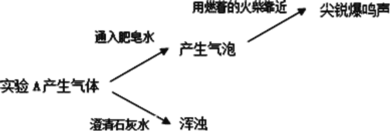
(2)实验 A 产生的气体有_____。
实验三:分别取少量实验 A 和 B 的上层清液于两支试管中,各加入 2 滴 BaCl2 溶液,A 中立即产生白色沉淀,B 中无明显现象。
(3)实验三说明 Mg 与 NaHCO3 溶液反应产生了_____(填离子符号)。对 A 中白色固体的成分提出假设:
I.白色固体是 Mg(OH)2;II.白色固体是 MgCO3;III.白色固体是碱式碳酸镁。
实验四:
将 A 中白色沉淀过滤、洗涤后,取 0.1mol 加入 1mol/L 盐酸 800mL 恰好完全反应,产生标况下的 CO2 气体 6.72L。
(4)白色沉淀的主要成分为_____(写化学式)。
(5)综上所述,结合平衡移动原理解释实验 A 中产生现象的原因____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了证明二氧化硫和氯气的漂白性,设计了如下图所示的实验装置:
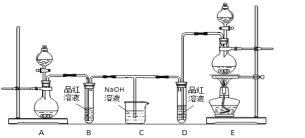
他们制备二氧化硫和氯气所依据的原理分别是:
Na2SO3+H2SO4 = Na2SO4+H2O+SO2↑
MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用来制取氯气的装置是______(填字母),反应中浓盐酸所表现出________________性质。
(2)反应开始一段时间后,B、D试管中的品红溶液均退色。停止通气后,再给B、D两个试管分别加热____ (填" B”或“D")试管中无明显现象。
(3)装置C的作用是________________________;
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是____________________________;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不退色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维纶(聚乙烯醇缩甲醛纤维)可用于生产服装、绳索等。其合成路线如下:
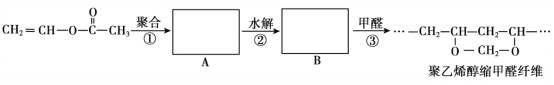
下列说法不正确的是
A.反应①是加聚反应
B.高分子A的链节中只含有一种官能团
C.通过质谱法测定高分子B的平均相对分子质量,可得其聚合度
D.反应③的化学方程式为:![]() +nHCHO→
+nHCHO→![]() +(2n-1)H2O
+(2n-1)H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com