
【题目】某学习小组探究 Mg 与 NaHCO3 溶液反应的机理,做了如下探究。
实验一:
实验 A | 实验 B | |
操作 | 在注射器中加入过量镁片(擦去表面氧化膜), 吸入 15mL 饱和 NaHCO3 溶液。 | 在注射器中加入过量镁片(擦去表面 氧化膜),吸入 15mL 蒸馏水。 |
现象 | 有气体产生,20min 后注射器内壁和底部产生 大量白色沉淀 | 缓慢产生气体 |
(1)写出 B 中生成气体的化学方程式_____。
实验二:
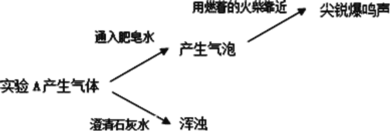
(2)实验 A 产生的气体有_____。
实验三:分别取少量实验 A 和 B 的上层清液于两支试管中,各加入 2 滴 BaCl2 溶液,A 中立即产生白色沉淀,B 中无明显现象。
(3)实验三说明 Mg 与 NaHCO3 溶液反应产生了_____(填离子符号)。对 A 中白色固体的成分提出假设:
I.白色固体是 Mg(OH)2;II.白色固体是 MgCO3;III.白色固体是碱式碳酸镁。
实验四:
将 A 中白色沉淀过滤、洗涤后,取 0.1mol 加入 1mol/L 盐酸 800mL 恰好完全反应,产生标况下的 CO2 气体 6.72L。
(4)白色沉淀的主要成分为_____(写化学式)。
(5)综上所述,结合平衡移动原理解释实验 A 中产生现象的原因____________________________。
【答案】Mg+2H2O=Mg(OH)2+H2↑ CO2 CO32- Mg4(OH)2(CO3)3 在碳酸氢钠溶液中存在着电离平衡HCO3- H++ CO32-和水解平衡HCO3- + H2OH2CO3+OH-,Mg与H+反应生成Mg2+和H2促进了电离平衡正向移动,Mg2+和CO32-、OH-反应生成Mg4(OH)2(CO3)3沉淀,减少了CO32-、OH-的浓度,不仅促进了电离平衡正向移动,也促进了水解平衡正向移动,H2CO3的浓度增大并分解为CO2。
【解析】
该学习小组探究 Mg 与NaHCO3溶液反应的机理,根据产生的气体具有可燃性可知气体中有H2;根据产生的气体能使澄清的石灰水变浑浊,可以确定其中有CO2;根据实验三可知反应后的溶液中有CO32-;根据定量实验的数据可以确定沉淀的化学式;根据平衡移动原理可说明该反应的机理。
(1)镁在常温下可以与水缓慢反应生成氢氧化镁和氢气,所以B 中生成气体的化学方程式为Mg+2H2O=Mg(OH)2+H2↑。
(2)实验 A 产生的气体能使澄清的石灰水变浑浊,说明A中产生的气体中还有CO2。
(3)分别取少量实验 A 和 B 的上层清液于两支试管中,各加入 2 滴BaCl2溶液,A 中立即产生白色沉淀,该沉淀可能为碳酸钡,说明 Mg 与NaHCO3溶液反应产生了CO32-。
(4)取 0.1mol 白色沉淀加入 1mol/L 盐酸 800mL 恰好完全反应,根据Cl-守恒可知n(MgCl2)=0.4mol;根据产生标况下的CO2气体 6.72L,可知CO2气体的物质的量为0.3mol,则n(CO32-)=0.3mol;根据电荷守恒可知,n(OH-)=0.2mol。因此,白色沉淀的主要成分为Mg4(OH)2(CO3)3。
(5)在碳酸氢钠溶液中存在着电离平衡HCO3- H++ CO32-和水解平衡HCO3- + H2OH2CO3+OH-。Mg与H+反应生成Mg2+和H2促进了电离平衡正向移动,Mg2+和CO32-、OH-反应生成Mg4(OH)2(CO3)3沉淀,减少了CO32-、OH-的浓度,不仅促进了电离平衡正向移动,也促进了水解平衡正向移动,H2CO3的浓度增大并分解为CO2。综上所述,实验 A 中产生现象的原因是:在碳酸氢钠溶液中存在着电离平衡HCO3- H++ CO32-和水解平衡HCO3- + H2OH2CO3+OH-,Mg与H+反应生成Mg2+和H2促进了电离平衡正向移动;Mg2+和CO32-、OH-反应生成Mg4(OH)2(CO3)3沉淀,减少了CO32-和OH-的浓度,不仅促进了电离平衡正向移动,也促进了水解平衡正向移动,H2CO3的浓度增大并分解为CO2。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)亚硝酰氯(ClNO)是有机合成中常用试剂,已知:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应。
2ClNO(g) △H<0,一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应。
①下列可判断反应达平衡状态的是___________(填序号字母)。
A. 混合气体的平均相对分子质量不变 B. 混合气体密度保持不变
C. NO和Cl2的物质的量之比保持不变 D. 每消耗1 moI NO同时生成1molClNO
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有_________(填选项序号字母)。
A. 升高温度 B. 缩小容器体积 C. 再充入Cl2气体 D. 使用合适的催化剂
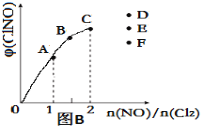
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图(B)所示,当n(NO)/n(Cl2)=2.5时,达到平衡状态,ClNO的体积分数可能是下图中D、E、F三点中的________点。
(2) 在体积为10 L的密闭容器中充入3 mol NO和2 mol Cl2,在不同温度下发生反应2NO(g)+Cl2(g)![]() 2ClNO(g),ClNO的百分含量随时间的变化如图所示。已知T1>T2>T3。
2ClNO(g),ClNO的百分含量随时间的变化如图所示。已知T1>T2>T3。
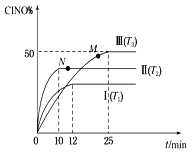
①与实验Ⅰ相比,实验Ⅱ除温度不同外,还改变的条件是__________________。
②实验Ⅲ反应至25 min达到平衡,用NO物质的浓度变化表示的反应速率为__________________。达到平衡时,若实验Ⅲ达到平衡时的热量变化为Q kJ,则该反应的热化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同一主族的X,Y,Z三种元素,已知其最高价含氧酸的钠盐溶液,等物质的量浓度时,溶液的pH大小为![]() ,则下列推断正确的是
,则下列推断正确的是
A.元素的非金属性强弱![]() B.相对原子质量
B.相对原子质量![]()
C.阴离子的还原性![]() D.气态氢化物稳定性
D.气态氢化物稳定性![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫和铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号)。
8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
根据以上信息回答下列问题:
a.除去Al3+的离子方程式是_____________________________________________________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为________。证明炉渣中含有FeO的实验现象为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1曰,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态Cr原子的价电子排布式为___。
(2)实验室常用KSCN溶液、苯酚(![]() )检验Fe3+。
)检验Fe3+。
①第一电离能:N___O(填“>”或“<”)。
②1mol苯酚中含有的σ数目为___。
③苯酚中的氧原子和碳原子均采用相同的杂化方式,其类型为___。
④从结构的角度分析苯酚的酚羟基有弱酸性的原因为___。
(3)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___空隙和___空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B(![]() ,0,
,0,![]() ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
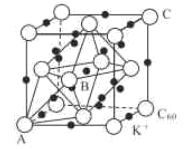
(4)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体Ni2与Ni3+产的最简整数比为___,晶胞参数为428pm,则晶体密度为___gcm-3(NA表示阿伏加德罗常数的值,列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒常用作化学工业中的催化剂,广泛用于冶金、化工生产。一种以钒渣(主要含有V2O3,还有少量FeO、Al2O3、SiO2等)为原料生产V2O5的工艺流程如图:

已知:VO![]() +H2O
+H2O![]() VO
VO![]() +2H+
+2H+
(1)“焙烧”时,V2O3转化为NaVO3的化学方程式是___。
(2)滤渣1为___(填化学式),“酸浸”后,调pH=7.6,除了得到沉淀Fe(OH)3、___,另一个目的是___。
(3)“沉钒”得到偏钒酸铵(NH4VO3)的离子方程式是___。图1是沉钒率随温度的变化曲线,温度高于80℃,沉钒率下降,其可能原因是___。
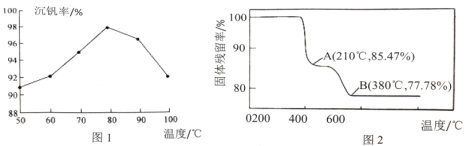
(4)在“煅烧”过程中,固体残留率(剩余固体质量/原始固体质量x100%)随温度变化的曲线如图2所示。NH4VO3分解过程中,先后失去的物质分别是___、___。(填化学式)
(5)金矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+![]() VO2++H2O+V3+,电池充电时,阳极的电极反应式为___。
VO2++H2O+V3+,电池充电时,阳极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,纯水中的c(H+)=2×10-7 mol/L,则此时c(OH-)=___。若温度不变,滴入稀硫酸使c(H+)=5×10-6mol/L,则由水电离出的c(H+)为___。
(2)常温下有一pH=12的NaOH溶液100mL,欲使它的pH降为11。
①如果加入蒸馏水,就加入___mL;
②如果加入pH=10的NaOH溶液,应加入___mL;
③如果加入0.008mol/L HCl溶液,应加入____mL。
(3)常温下,浓度均为0.01 mol/L的两瓶溶液盐酸和氢氟酸,升高相同的温度c(Cl-)/c(F-)的值____(填“变大”“变小”“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是

A. 加入Na2SO4可使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com