
【题目】A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;B、C、D同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题: (相关问题用元素符号表示)
(1)写出E的基态原子的电子排布式________________________。
(2)B与C可形成化合物BC和BC2,BC2属于__________(填“极性”、“非极性”)分子,1 mol BC含有π键为____________________mol。
(3)由元素A、C、G组成的离子[G(A2C)4]2+在水溶液中显天蓝色,不考虑空间结构,[G(A2C)4]2+的结构可用示意图表示为__________(配位键用→标出)。
(4)测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的原因是_______。
(5)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质,分子中含三个相同的原子团,其结构简式为________________,分子中F原子的杂化方式为__________,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为____________________。
(6)G与氮元素形成的某种化合物的晶胞结构如图,则该化合物的化学式为__________,若晶体密度为a g·cm-3,列式计算G原子与氮原子最近的距离为__________pm(不必计算出数值,阿伏加德罗常数的值用NA表示)。

【答案】1s22s22p63s2 非极性 2 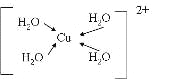 HF分子之间存在氢键,形成缔合分子 Al(CH3)3 sp2杂化 Al(CH3)3+3H2O = Al(OH)3↓+3CH4↑ Cu3N
HF分子之间存在氢键,形成缔合分子 Al(CH3)3 sp2杂化 Al(CH3)3+3H2O = Al(OH)3↓+3CH4↑ Cu3N 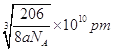
【解析】
在前四周期中原子序数依次增大的七种元素A、B、C、D、E、F、G中,A的原子核外电子只有一种运动状态,故A为H;B、C的价电子层中未成对电子数都是2,则B、C核外电子排布为1s22s22p2或1s22s22p4,为C、O;B、C、D同周期且原子序数依次增大,故D为F;E核外的s、p能级的电子总数相等,故E为Mg,F与E同周期且第一电离能比E小,F为Na,G的+1价离子(G+)的各层电子全充满,元素的基态原子最外能层只有一个电子,其它能层均已充满电子,则核外电子数为2+8+18+1=29,故G为Cu。
(1)E为Mg元素,基态原子的电子排布为1s22s22p63s2;
(2)B(C)与C(O)可形成化合物BC(CO)和BC2(CO2),CO2结构式为O=C=O,电荷中心重合,为非极性分子,CO的结构式为C≡O,含有2molπ键;
(3)Cu(H2O)42+,水与铜离子形成4个配位键,结构为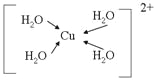 ;
;
(4)测定A、D形成的化合物HF的相对分子质量时,实验测定值一般高于理论值的原因是HF分子之间存在氢键,形成缔合分子;
(5)由元素H、C、Al组成的原子个数比9:3:1的一种物质,分子中含三个相同的原子团,其结构简式为Al(CH3)3,根据价层电子对互斥理论计算电子对数为3+(3-3×1)/2=3,杂化类型为sp2,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为Al(CH3)3+3H2O=Al(OH)3↓+3CH4↑;
(6)晶胞中Cu原子数目=12×1/4=3、N原子数目=8×1/8=1,故化学式为:Cu3N;晶胞的质量=(64×3+14)÷NAg,紧邻的白球与黑球之间的距离为bcm,则晶胞棱长=2bcm,则晶胞体积=(2bcm)3,故晶体的密度=[(64×3+14)÷NA]÷(2bcm)3=agcm-3,b=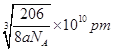 。
。
【点晴】
该题难度较大,元素推断是解题的关键,需要学生具备扎实的基础,(6)中注意利用均摊法计算晶胞质量是解答的难点和易错点。晶胞中原子的数目往往采用均摊法,具体方法为:①位于晶胞顶点的原子为8个晶胞共用,对一个晶胞的贡献为1/8;②位于晶胞面心的原子为2个晶胞共用,对一个晶胞的贡献为1/2;③位于晶胞棱心的原子为4个晶胞共用,对一个晶胞的贡献为1/4;④位于晶胞体心的原子为1个晶胞共用,对一个晶胞的贡献为1。


科目:高中化学 来源: 题型:
【题目】分子式为C8H8的两种同分异构体X和Y。Y是一种芳香烃,分子中只有一个环;X俗称立方烷,其核磁共振氢谱显示只有一个吸收峰。下列有关说法错误的是( )
A.X、Y均能燃烧,都有大量浓烟产生
B.X既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,还能发生加聚反应
C.Y属于不饱和烃
D.X的二氯代物有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语解释相关现象正确的是( )
A.向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH-
B.常温下,0.1 mol/L的HF 溶液的pH>1:HF+H2O![]() H3O++F-
H3O++F-
C.KHSO4在熔融状态下可导电:KHSO4 = K++H++SO42-
D.BaSO4的水溶液导电性极弱:BaSO4![]() Ba2++SO42-
Ba2++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室探究过渡金属元素化合物的性质
I、铁及其化合物

(1)向FeSO4溶液中滴加NaOH溶液,产生白色沉淀,但迅速变为灰绿色,最终变为红褐色,为顺利看到较长时间的白色沉淀,设计了图①装置:①检查装置气密性,装入药品;②打开止水夹K;③在试管b出口收集气体并验纯;④关闭止水夹K。以上操作正确的顺序是:___。
(2)某实验小组称量3.60 g草酸亚铁晶体(FeC2O4·2H2O)加热过程中,固体质量变化如图②所示:
①请写出AB段发生反应的化学方程式:___。②C点成分为:___。
(3)向FeCl3溶液中加入过量Na2SO3溶液,设计实验证明两者发生了氧化还原反应并且为可逆反应。(简要说明实验步骤、现象和结论,仪器和药品自选)___。
II、铜及其化合物
向2ml0.2mol·L-1Na2SO3溶液中滴加0.2mol·L-1CuSO4溶液,发现溶液变绿,继续滴加产生棕黄色沉淀,经检验,棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。
已知:Cu+![]() Cu+Cu2+,Cu2+
Cu+Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
(4)用稀硫酸证实沉淀中含有Cu+的实验现象是___。
(5)向洗净的棕黄色沉淀中加入足量KI溶液,产生白色沉淀,继续向上层清液中加入淀粉溶液并没有变蓝的现象出现,请结合离子反应方程式解释不变蓝的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.2000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1) 配平离子方程式:______MnO4-+HSO3-+H+=Mn2++SO42-+H2O。
(2)用KMnO4进行滴定时,KMnO4溶液应装在_______________中,判断滴定终点的现象是_______。
(3)下列操作会导致测定结果偏高的是_________。
A. 盛装未知浓液的锥形瓶用蒸馏水洗过,未用待测液润洗
B. 未用标准浓度的酸性KMnO4溶液润洗滴定管
C. 观察读数时,滴定前仰视,滴定后俯视
D. 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4) 根据下表测定的实验数据,计算KMnO4溶液体积的平均值为___mL;NaHSO3溶液的物质的量浓度为___mol/L(数据精确到0.1)。
试验编号 | 待测NaHSO3溶液的体积/ mL | KMnO4溶液体积/ mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水资源非常重要,联合国确定2003年为国际淡水年.海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程![]() 又称海水脱盐
又称海水脱盐![]() ,其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等.下列方法中也可以用来进行海水淡化的是
,其方法较多,如反渗透法、水合物法、电渗透法、离子交换法和压渗法等.下列方法中也可以用来进行海水淡化的是
A.过滤法B.蒸馏法C.萃取法D.蒸发法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按系统命名法填写下面有机物的名称: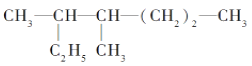 _________________
_________________
(2)2,6-二甲基-4-乙基辛烷的结构简式是______________________,1 mol该烃完全燃烧需消耗氧气________mol。
(3)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子对。试完成下列问题:
①分子式为CnH2n+2的烃分子中碳碳间共用电子对数为________。
②符合该条件的单烯烃的分子式为________。
(4) 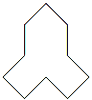 分子式为________,按碳的骨架分,该有机物属于________。(填字母序号)
分子式为________,按碳的骨架分,该有机物属于________。(填字母序号)
a. 环状化合物 b. 脂环烃 c. 芳香化合物 d. 苯的同系物
(5)2,2-二甲基丙烷的习惯命名为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷和氯气反应生成PCl3的热化学方程式为P4(白磷,g)+6Cl2(g)═4PCl3(g) ΔH=-1326kJ·mol-1,已知化学键键能为Cl—Cl键243kJ·mol-1,P—Cl键331kJ·mol-1。白磷和PCl3的分子结构如图所示,则P—P键的键能为( )
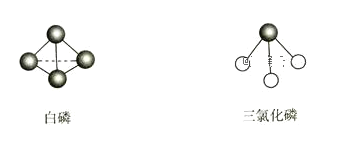
A.396kJ·mol-1B.198kJ·mol-1
C.99kJ·mol-1D.49.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小分子抗癌药物的分子结构如图所示,下列说法正确的是

A. 1mol该有机物最多可以和5mol NaOH反应
B. 该有机物容易发生加成、取代、中和、消去等反应
C. 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D. 1mol该有机物与浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com