
【题目】某化学小组欲探究FeCl3溶液、FeCl2溶液的化学性质
试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片
请帮助他们完成以下实验报告:
序号 | 实验 目的 | 实验内容 | 实验现象 | 实验结论 | 离子方程式 |
实验1 | ① | 在FeCl2溶液中滴入适量 氯水 | 溶液由浅绿色 变为黄色 | ② | ③ |
实验2 | ④ | 在FeCl2溶液中加入锌片 |
| ⑤ | Zn +Fe2+= Zn2++Fe |
实验3 | ⑥ | 在FeCl3溶液中加入足量 铁粉 | ⑦ | FeCl3(Fe3+)具有氧化性 | ⑧ |
填空:
(1)①_____________③____________ ⑤____________⑧____________
综合以上实验,你能得到的结论是:Fe3+有氧化性;_________________。
(2)亚铁盐溶液易被氧化,短时间保存亚铁盐溶液时为防止亚铁盐被氧化可在溶液中加入少量______________(填试剂名称)。
(3)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可):________。
(4)某同学向FeCl2溶液中加入Na2O2,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是___。
【答案】验证Fe2+具有还原性2Fe2++Cl2══2Fe3++2Cl-证明Fe2+具有氧化性2Fe3++Fe══3Fe2+Fe2+既有氧化性,又有还原性加入少量铁粉加入KSCN溶液,无现象,再加入氯水(双氧水等合理氧化剂),溶液变血红色或者加入K3[Fe(CN)6]产生蓝色沉淀Na2O2将Fe2+氧化为Fe3+,Fe3+转化为Fe(OH)3沉淀
【解析】(1)由实验过程及结论可知,实验1的实验目的是验证Fe2+具有还原性,在FeCl2溶液中滴入适量氯水,根据实验现象可知,氯化亚铁能被氯气氧化,生成铁离子和氯离子,反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-;实验2的实验目的是验证Fe2+具有氧化性,能被锌置换出来,生成铁单质和锌离子,所以实验结论是证明Fe2+具有氧化性;实验3的实验目的是FeCl3(Fe3+)具有氧化性,铁离子与铁单质反应生成亚铁离子,实验现象为溶液由黄色变为浅绿色;综合以上实验,得到的结论是Fe3+有氧化性;Fe2+既有氧化性,又有还原性;
(2)亚铁盐在溶液中加入少量的铁粉可以防止亚铁离子被氧化;
(3)检验某溶液是Fe2+溶液的方法可以用K3[Fe(CN)6]溶液,看能否产生蓝色沉淀,也可以用KSCN溶液及氯水,KSCN溶液与亚铁离子没有明显现象,而遇铁离子能显血红色,所以检验的方法为加入KSCN溶液,无现象,再加入氯水(双氧水等合理氧化剂),溶液变血红色,或者加入K3[Fe(CN)6]产生蓝色沉淀;
(4)某同学向FeCl2中加入Na2O2,考虑到2H2O+Na2O2=4NaOH+O2↑,过氧化钠有强氧化性,能氧化亚铁离子生成铁离子,铁离子可以与NaOH溶液作用转化成氢氧化铁,氢氧化铁沉淀为红褐色。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】将5.1g镁铝合金溶于70ml4mol/L硫酸中,当合金完全溶解后,再加入70ml8mol/L的NaOH溶液,得沉淀的质量为13.6g,则加入硫酸时,产生H2的物质的量为
A. 0.2mol B. 0.25mol C. 0.3mol D. 0.35mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用硫铁矿石(主要成分FeS2)在沸腾炉中焙烧,经过一系列反应,得到硫酸,焙烧后的矿渣用于炼铁。其转化过程如下图所示(部分条件、反应物和产物已略去):
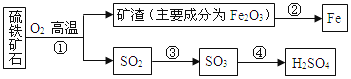
请回答下列问题:
(1)在上面转化过程中,硫元素被氧化的反应是________(填反应编号)。
(2)写出反应②中炼铁的化学方程式_____________。若用1000t含杂质28%的矿渣炼铁,理论上可得到含铁96%的生铁质量为_____________ t.
(3)写出反应①的化学方程式 ,若有12.0g FeS2参加反应,则发生转移的电子数为 。
(4)烟气中SO2的排放会造成酸雨,工业上常用Na2SO3溶液来吸收SO2以减少对环境的危害。
①常温下,将SO2通入一定体积的1.0mol·L-1Na2SO3溶液中,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,此时溶液中c(SO32-)的浓度是0.2mol·L-1,则溶液中c(HSO3-)是 mol·L-1。用化学平衡原理解释此时溶液显酸性的原因 。
②向①中pH约为6时的吸收液中通入足量O2充分反应。取反应后溶液10mL与10mLBaCl2溶液混合,欲使混合时能生成沉淀,所用BaCl2溶液的浓度不得低于 mol·L-1。[已知25℃时,Ksp(BaSO3)=5.48×10-7, Ksp(BaSO4)= 1.08×10-10]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 向氯化铝溶液中加入过量氨水:4NH3·H2O+Al3+===AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
B. 将铝片打磨后置于NaOH溶液中:2Al+2OH-===2AlO![]() +H2↑
+H2↑
C. 向明矾溶液中加入Ba(OH)2溶液至SO![]() 完全沉淀:Al3++2SO
完全沉淀:Al3++2SO![]() +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO![]() +2H2O
+2H2O
D. 水玻璃中通入过量的二氧化碳的离子方程式为:SiO![]() +CO2+H2O===H2SiO3↓+CO
+CO2+H2O===H2SiO3↓+CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属防腐的措施中,使用牺牲阳极的阴极保护法的是( )
A. 水中的钢闸门连接电源的负极 B. 金属护栏表面涂漆
C. 汽车底盘喷涂高分子膜 D. 地下钢管连接镁块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的叙述错误的是
A. 饱和食盐水属于混合物
B. Na2CO3即属于钠盐又属于碳酸盐
C. CuSO4·5H2O属于混合物
D. 纯净物一般可分成单质和化合物两类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,1g氢气燃烧生成液态水,放出142.9kJ热量,能表示H2燃烧热的热化学方程式为( )
A.2H2(g)+O2(g)==2H2O(1) △H=―571.6kJ/mol![]()
B.2H2(g)+O2(g)==2H2O(1) △H=+571.6kJ/mol
C.H2(g)+![]() O2(g)==H2O(g) △H=―285.8kJ/mol
O2(g)==H2O(g) △H=―285.8kJ/mol
D.H2(g)+![]() O2(g)==H2O(1) △H=―285.8kJ/mol
O2(g)==H2O(1) △H=―285.8kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com