
【题目】下列金属防腐的措施中,使用牺牲阳极的阴极保护法的是( )
A. 水中的钢闸门连接电源的负极 B. 金属护栏表面涂漆
C. 汽车底盘喷涂高分子膜 D. 地下钢管连接镁块
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol ·L-1、0.1 mol ·L-1、0.2 mol ·L-1。当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol ·L-1、0.1 mol ·L-1、0.2 mol ·L-1。当反应达平衡时,可能存在的数据是
A. SO2为0.4 mol ·L-1,O2为0.2 mol ·L-1 B. SO2为0.25 mol ·L-1
C. SO2、SO3均为0.15 mol ·L-1 D. SO3为0.4 mol ·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
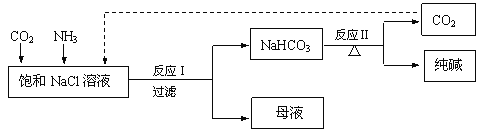
已知反应I为:NaCl + CO2 + NH3 + H2O === NaHCO3↓+ NH4Cl
(1)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42等离子。
① 为得到纯净的饱和NaCl溶液,进行了如下操作。请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中加入过量___________________(填试剂名称),过滤;
c.向滤液中加入过量___________________(填试剂名称),过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
② 步骤c中反应的离子方程式是______________________。
(2)反应II的化学方程式是_________________________。
(3)制得的纯碱中含有少量NaCl。取5.5 g纯碱样品加入足量稀硫酸,得到标准状况下1120 mL CO2。则样品中纯碱的质量分数是_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤造成空气污染。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
写出该反应平衡常数表达式:K=__________。
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)________V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是__________。
A. 容器中密度不变
B. 容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2) :v(H2) =1:3
E.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
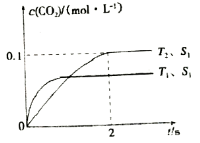
①在T2温度下,0~2 s内的平均反应速率v(N2)=__________;
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1〉S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线。
(3)工业上用CO和H2合成 CH3OH:CO (g) +2H2 (g) ![]() CH3OH (g)
CH3OH (g)
①现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是____________
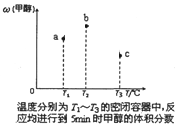
A.正反应的△H>0
B.反应进行到5 min时,b容器中v正=v逆
C.减压可使甲醇的含量由b点变成c点
D.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲探究FeCl3溶液、FeCl2溶液的化学性质
试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片
请帮助他们完成以下实验报告:
序号 | 实验 目的 | 实验内容 | 实验现象 | 实验结论 | 离子方程式 |
实验1 | ① | 在FeCl2溶液中滴入适量 氯水 | 溶液由浅绿色 变为黄色 | ② | ③ |
实验2 | ④ | 在FeCl2溶液中加入锌片 |
| ⑤ | Zn +Fe2+= Zn2++Fe |
实验3 | ⑥ | 在FeCl3溶液中加入足量 铁粉 | ⑦ | FeCl3(Fe3+)具有氧化性 | ⑧ |
填空:
(1)①_____________③____________ ⑤____________⑧____________
综合以上实验,你能得到的结论是:Fe3+有氧化性;_________________。
(2)亚铁盐溶液易被氧化,短时间保存亚铁盐溶液时为防止亚铁盐被氧化可在溶液中加入少量______________(填试剂名称)。
(3)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可):________。
(4)某同学向FeCl2溶液中加入Na2O2,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为:Mg17Al12 + 17H2=17MgH2 + 12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
⑴ 熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是
⑵ 在6.0 mol·L-1HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2的物质的量为
Ⅱ.某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2―→O2
⑴ 该反应中的还原剂是
⑵ 该反应中,发生还原反应的过程是 →
⑶ 写出该反应的化学方程式,并标出电子转移的方向和数目 ;
⑷ 若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.CO2和SiO2都是酸性氧化物,所以两者物理性质相似
B.因为CaCO3+SiO2=CaSiO3+CO2↑,所以硅酸的酸性比碳酸强
C.CO2和SiO2都能与碳反应,且都作氧化剂
D.SiO2晶体熔、沸点高,硬度大,故可用于制做光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如下图所示。R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡。下列推断正确的是
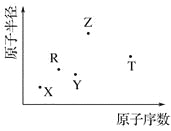
A. 原子半径和离子半径均满足:Y<Z
B. 最高价氧化物对应水化物的酸性:T<R
C. 氢化物的沸点不一定是:Y>R
D. 由 X、R、Y、Z 四种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com