
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol ·L-1、0.1 mol ·L-1、0.2 mol ·L-1。当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol ·L-1、0.1 mol ·L-1、0.2 mol ·L-1。当反应达平衡时,可能存在的数据是
A. SO2为0.4 mol ·L-1,O2为0.2 mol ·L-1 B. SO2为0.25 mol ·L-1
C. SO2、SO3均为0.15 mol ·L-1 D. SO3为0.4 mol ·L-1
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l);ΔH=+725.8 kJ/mol
O2(g)=CO2(g)+2H2O(l);ΔH=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-1452 kJ/mol
C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=+1452 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或处理事故的方法正确的是( )
A. 用分液漏斗分离乙酸乙酯和水的混合物时,水从下口放出,乙酸乙酯从上口倒出
B. 在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验
C. 用干燥的pH试纸测定NaClO溶液的pH
D. 欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极惰性电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是( )
A 稀NaOH溶液 B HCl溶液 C NaCl溶液 D 酸性AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用所学知识,回答下列问题。
I、向硫酸铜溶液中逐滴加入KI溶液至恰好反应完全,观察到产生白色沉淀CuI,蓝色溶液变为棕色。该反应的离子方程式为__________;取一定量上述反应后的上层棕色清液于一支试管中,加入一定量的苯,振荡,此时观察到的现象是________。
II、工业上用铝土矿(主要成分为Al2O3,只含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
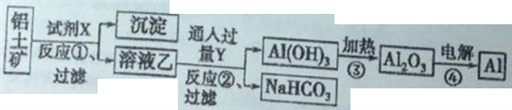
回答下列问题:
(1)上述反应是否都是氧化还原反应_________(填“是”或“否”);写出反应①的化学方程式_____。
(2)反应①后过滤的沉淀为_______,简述确定此物质中金属元素及其价态的操作过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列有关说法正确的是
A. 该合成中所有的电能和热能全部转化为化学能
B. 该合成氨过程不属于氮的固定
C. 空气、水、太阳能均为可再生资源
D. 断裂N2中的N≡N键会释放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属防腐的措施中,使用牺牲阳极的阴极保护法的是( )
A. 水中的钢闸门连接电源的负极 B. 金属护栏表面涂漆
C. 汽车底盘喷涂高分子膜 D. 地下钢管连接镁块
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com