
����Ŀ��80 ��ʱ��2 L �ܱ������г���0.40 mol N2O4��������ӦN2O4![]() 2NO2 ��H����Q kJ��mol-1��Q��0��������������ݣ�
2NO2 ��H����Q kJ��mol-1��Q��0��������������ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol��L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
�����ж���ȷ������ ��
A. �����¶ȸ÷�Ӧ��ƽ�ⳣ��K��С
B. 20��40 s �ڣ�v��N2O4����0.004 mol��L-1��s1
C. ��Ӧ��ƽ��ʱ�����յ�����Ϊ0.30 Q kJ
D. 100 s ʱ��ͨ��0.40 mol N2O4������ƽ��ʱN2O4��ת��������
���𰸡�C
������������ A�÷�ӦΪ���ȷ�Ӧ,�¶�����,ƽ�������ȵķ����ƶ�����������Ӧ�����ƶ�,ƽ�ⳣ��K����,A����B�����ݱ������ݿ�֪20��40s �ڵķ�Ӧ����Ϊv(NO2)��![]() ����Ӧ����֮���ǻ�ѧ������֮�ȣ���v(N2O4)��0.5v(NO2)��0��002mol/(L��s)��B����C��Ũ�Ȳ���ʱ��˵����Ӧ�Ѵ�ƽ�⣬��Ӧ��ƽ��ʱ������NO2�����ʵ���Ϊ0��30molL-1��2L��0��60mol�����Ȼ�ѧ����ʽ��֪����2molNO2��������QkJ����������0��6molNO2��������0��3QkJ��C��ȷ��D��100sʱ��ͨ��0��40mol N2O4��ƽ��״̬�൱������ѹǿ��ƽ�������ƶ���N2O4��ת���ʼ�С��D����ѡC��
����Ӧ����֮���ǻ�ѧ������֮�ȣ���v(N2O4)��0.5v(NO2)��0��002mol/(L��s)��B����C��Ũ�Ȳ���ʱ��˵����Ӧ�Ѵ�ƽ�⣬��Ӧ��ƽ��ʱ������NO2�����ʵ���Ϊ0��30molL-1��2L��0��60mol�����Ȼ�ѧ����ʽ��֪����2molNO2��������QkJ����������0��6molNO2��������0��3QkJ��C��ȷ��D��100sʱ��ͨ��0��40mol N2O4��ƽ��״̬�൱������ѹǿ��ƽ�������ƶ���N2O4��ת���ʼ�С��D����ѡC��


 ͬ��ѧ��һ�ζ���ϵ�д�
ͬ��ѧ��һ�ζ���ϵ�д� �����ܾ�ϵ�д�
�����ܾ�ϵ�д� ���ƿ�����ϵ�д�
���ƿ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣���ش��������⣺
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0�� | |
1 | �� | |||||||
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� |
(1)����ЩԪ���У����ʵĻ�ѧ�������������___����Ԫ�ط��ţ���
(2)�۵���̬�⻯��ĵ���ʽ___���ڢ��γɵ���̬������Ľṹʽ___��
(3)��ЩԪ���γɵ�����������ˮ�����У�������ǿ�Ļ�����Ϊ___�������ʵĻ�ѧʽ����д�����ĵ���ʽ��___��������ǿ�ĺ�����Ϊ___�������ʵĻ�ѧʽ����д�����ĵ��뷽��ʽ��___��
(4)�ڢں͢�����Ԫ���У��ǽ����Խ�ǿ����___����Ԫ�����ƣ����ڵĵ��ʿ��Ժ͢۵�����������ˮ���ﷴӦ����д���йػ�ѧ����ʽ___��
(5)����SiԪ�طֱ��γɵ���������___���۵���ߣ�ԭ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����У�ͬʱ�����Ӽ������Թ��ۼ��ͷǼ��Թ��ۼ��Ķ��Ѻ��γɵķ�Ӧ�ǣ�������
A.NH4Cl![]() NH3����HCl��B.2Na2O2��2CO2=2Na2CO3��O2
NH3����HCl��B.2Na2O2��2CO2=2Na2CO3��O2
C.2NaOH��Cl2=NaCl��NaClO��H2OD.NH3��CO2��H2O=NH4HCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ�����⡣���պϸ�װ �õĿ���ʱ���۲쵽��������ָ�뷢����ƫת��
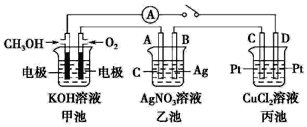
��ش��������⣺
(1)�׳�Ϊԭ��أ�ͨ�� CH3OH �缫�ĵ缫��ӦΪ________��
(2)�ҳ���A(ʯī)�缫������Ϊ_____(������������������������������������)���ܷ�ӦΪ_____��
(3)���ҳ�B���������� 5.4 g ʱ���׳������������� O2 �����Ϊ_____mL(��״��)������D������_____g ͭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ���������ε�����a��b��c��d��e��f������ЩԪ����ɵĻ����mΪ���ʣ�d�ǵ���ɫ��ĩ��b�������г�����Һ̬������������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ����

A. ������a��ֻ����C��H����Ԫ��
B. ����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С˳��ΪZ��Y��X��W
C. d�����ӻ�����������Ӹ�����Ϊ1��2
D. Y��W�γɵļ�������ͬ����Ԫ��ͬ���ͻ������зе���͵�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���Ԫ�������ɣ��ж�������������ȷ����

A. ��̬�⻯����ȶ��ԣ�H2O��NH3��SiH4
B. ��Ԫ��������Ԫ�ؿ��γɹ��ۻ���������ӻ�����
C. ��ͼ��ʾʵ���֤��Ԫ�صķǽ����ԣ�Cl��C��Si
D. ��������![]() ������o�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
������o�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������������ȷ����
A.��״���£�22.4LSO3����NA������
B.1molNaHSO4����ˮ��������������ĿΪ2NA
C.��״���£�2.24LN2��O2�Ļ�������з�����Ϊ0.1NA
D.0.1mol��L��1��Ba(OH)2��Һ�к��е�OH����ĿΪ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϴ�����CO��SO2�̵�����Ⱦ��һ�ַ������ǽ����ڴ���������ת��Ϊ����S��CO2����֪��CO(g)+1/2O2(g)�TCO2(g)��H=��283.0kJmol��1 S(s)+O2(g)�TSO2(g)��H=��296.0kJmol��1�˷�Ӧ���Ȼ�ѧ����ʽ��(�� ��)
A. CO(g)+1/2SO2(g)�T1/2S(s)+CO2(g)��H=+135kJ/mol
B. CO(g)+1/2SO2(g)�T1/2S(s)+CO2(g)��H=+13kJ/mol
C. 2CO(g)+SO2(g)�TS(s)+2CO2(g)��H=��582kJ/mol
D. 2CO(g)+SO2(g)�TS(s)+2CO2(g)��H=��270kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com