
【题目】铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
①ZnSO4+2FeSO4+3Na2C2O4+6H2O![]() ZnFe2(C2O4)3·6H2O↓+3Na2SO4
ZnFe2(C2O4)3·6H2O↓+3Na2SO4
②ZnFe2(C2O4)3·6H2O![]() ZnFe2O4+2CO2 ↑+4CO↑+6H2O
ZnFe2O4+2CO2 ↑+4CO↑+6H2O
回答下列问题:
(1)基态 Fe2+的价层电子排布图为___________.
(2)电离能大小比较:I1(Zn)___________ I1(Cu),I2(Zn)___________ I2 (Cu) (填“>”“<”或“=”)。
(3)Na2SO4 中阴离子的空间构型是___________,该离子中 S 的杂化类型是_____。
(4)CO和N2的分子结构相似,标准状况下,VLCO2和CO的混合气体中含键的物质的量为___________。与CO2互为等电子体的离子有____________(写一种即可)。
(5)ZnCl2、ZnBr2、ZnI2 的熔点依次为283℃、394℃、446℃,其主要原因是___________。
(6)铁和碳组成的某种晶体的晶胞如图所示。面心上铁原子相连构成正八面体。
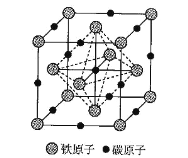
已知该晶体的密度为 dg·cm-3,NA 是阿伏加德罗常数的值。
①该晶体中Fe、C原子的最简比为___________。
②该晶胞中相邻两个面心上铁原子最近的核间距离 D=___________nm(只列计算式)。
【答案】![]() > < 正四面体 sp3
> < 正四面体 sp3 ![]() mol N3-(或NO2+、SCN-等) 它们都形成分子晶体,相对分子质量依次增大,分子间作用力依次增大,所以熔点依次升高 1:1
mol N3-(或NO2+、SCN-等) 它们都形成分子晶体,相对分子质量依次增大,分子间作用力依次增大,所以熔点依次升高 1:1 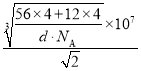
【解析】
(1)基态 Fe2+的电子排布式为1s22s22p63s23p63d6,由此可确定Fe2+的价层电子排布图;
(2)Zn的价电子排布式为3d104s2,Cu的价电子排布式为3d104s1,从半满、全满时能量低,第一电离能高进行电离能大小比较;
(3)Na2SO4中阴离子的价层电子对数为4,由此确定空间构型和该离子中 S 的杂化类型;
(4) CO2和CO的分子内都含有2个键,寻找CO2互为等电子体的离子时,可将C、O进行相近原子的替换,电子的差异可用带电荷代替;
(5)ZnCl2、ZnBr2、ZnI2 若为离子晶体,则与熔点关系不相符,所以应形成分子晶体;
(6)①采用均摊法,计算该晶体中Fe、C原子的最简比;
②先求出晶胞中所含有的Fe、C原子数,然后利用密度求体积,进而求出晶胞的边长,最后可利用小三角形,计算该晶胞中相邻两个面心上铁原子最近的核间距离 D。
(1)基态 Fe2+的电子排布式为1s22s22p63s23p63d6,则基态 Fe2+的价层电子排布图为![]() ,答案为:
,答案为:![]() ;
;
(2) Zn的价电子排布式为3d104s2,Cu的价电子排布式为3d104s1,则Zn的4s能级全充满,电子的能量低,失电子所需能量高,而Cu的4s能级半充满,则电离能:I1(Zn)>I1(Cu),Zn+的价电子排布式为3d104s1,Cu+的价电子排布式为3d10,则Cu+的3d能级全充满,失电子所需能量高,所以I2(Zn)< I2 (Cu),答案为:>;<;
(3) Na2SO4中SO42-的价层电子对数为4,则SO42-的空间构型是正四面体,该离子中 S 的杂化类型是sp3,答案为:正四面体;sp3;
(4) CO2和CO的分子内都含有2个键,标准状况下,VLCO2和CO的混合气体中含键的物质的量为![]() =
=![]() mol。依据就近原则,与CO2互为等电子体的离子有N3-(或NO2+、SCN-等),答案为:
mol。依据就近原则,与CO2互为等电子体的离子有N3-(或NO2+、SCN-等),答案为:![]() mol;N3-(或NO2+、SCN-等);
mol;N3-(或NO2+、SCN-等);
(5)从ZnCl2、ZnBr2、ZnI2 的熔点看,三者应形成分子晶体,其主要原因是它们都形成分子晶体,相对分子质量依次增大,分子间作用力依次增大,所以熔点依次升高,答案为:它们都形成分子晶体,相对分子质量依次增大,分子间作用力依次增大,所以熔点依次升高;
(6)①利用均摊法,该晶胞中含Fe原子数为8×![]() +6×
+6×![]() =4,含C原子数为12×
=4,含C原子数为12×![]() +1=4,该晶体中Fe、C原子的最简比为4:4=1:1,答案为:1:1;
+1=4,该晶体中Fe、C原子的最简比为4:4=1:1,答案为:1:1;
②设晶胞的边长为a,则a3=![]() ,a=
,a=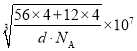 nm,该晶胞中相邻两个面心上铁原子最近的核间距离 D=
nm,该晶胞中相邻两个面心上铁原子最近的核间距离 D=![]() ×
×![]() =
=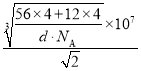 nm,答案为:
nm,答案为: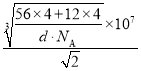 。
。


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B.CH3CH=CHCH3分子中的四个碳原子在同一直线上
C.按系统命名法,化合物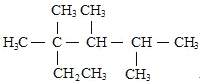 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
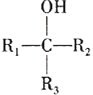
D.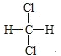 与
与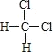 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是一种大气污染物,但它在化工和食品工业上却有广泛应用。某兴趣小组同学对SO2的实验室制备和性质实验进行研究。
(1)甲同学按照教材实验要求设计如图所示装置制取SO2
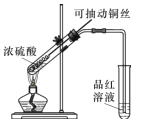
①本实验中铜与浓硫酸反应的化学方程式是 ______,铜丝可抽动的优点是_______。
②实验结束后,甲同学观察到试管底部出现黑色和灰白色固体,且溶液颜色发黑。甲同学认为灰白色沉淀应是生成的白色CuSO4夹杂少许黑色固体的混合物,其中CuSO4以白色固体形式存在体现了浓硫酸的________性。
③乙同学认为该实验设计存在问题,请从实验安全和环保角度分析,该实验中可能存在的问题是________。
(2)兴趣小组查阅相关资料,经过综合分析讨论,重新设计实验如下(加热装置略):
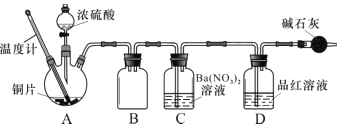
实验记录 A 中现象如下:
序号 | 反应温度/℃ | 实验现象 |
1 | 134 | 开始出现黑色絮状物,产生后下沉,无气体产生 |
2 | 158 | 黑色固体产生的同时,有气体生成 |
3 | 180 | 气体放出的速度更快,试管内溶液为黑色浑浊 |
4 | 260 | 有大量气体产生,溶液变为蓝色,试管底部产生灰白色固体,品红溶液褪色 |
5 | 300 | 同上 |
查阅资料得知: 产物中的黑色和灰白色固体物质主要成分为 CuS、Cu2S 和 CuSO4,其中CuS 和 Cu2S为黑色固体,常温下都不溶于稀盐酸,在空气中灼烧均转化为CuO和SO2。
①实验中盛装浓硫酸的仪器名称为 ____________。
②实验记录表明__________对实验结果有影响,为了得到预期实验现象,在操作上应该____________。
③装置C 中发生反应的离子方程式是 ___________________。
④将水洗处理后的黑色固体烘干后,测定灼烧前后的质量变化,可以进一步确定黑色固体中是否一定含有 CuS其原理为__________(结合化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A和化合物F为原料合成除草剂双苯噁唑酸(I)的一种工艺流程如下:
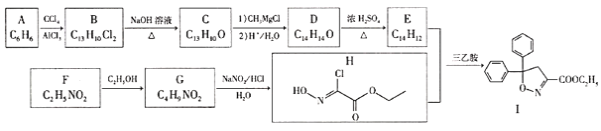
已知以下信息:
①B、C、D、E中均含有两个苯环。
②E能使Br2的CCl4溶液褪色,其核磁共振氢谱有4组峰,峰面积比为2:2:1:1;F中含有两种官能团且具有两性;G能发生水解反应。
③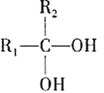 (不稳定)
(不稳定)![]()
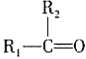
④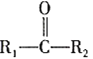
![]()
 ;RCl
;RCl![]() RMgCl
RMgCl
回答下列问题:
(1)F的化学名称为_______。
(2)A生成B、D生成E的反应类型依次为______________、___________________。
(3)E、G的结构简式依次为__________________、________________。
(4)B生成C的化学方程式为_________。
(5)芳香化合物X是D的同分异构体,X的苯环上有3个取代基,能与![]() 溶液发生显色反应,能使
溶液发生显色反应,能使![]() 的
的![]() 溶液褪色,X的核磁共振氢谱有5组峰且峰面积比为6:4:2:1:1,写出两种符合要求的X的结构简式:______________。
溶液褪色,X的核磁共振氢谱有5组峰且峰面积比为6:4:2:1:1,写出两种符合要求的X的结构简式:______________。
(6)根据题给信息,写出以乙醛为原料制备2-丁醇的合成路线:________(其他试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 X 分子式为C3H6O,有多种同分异构体。其中之一丙醛(液态)的燃烧热为1815kJ/mol。下列说法不正确的是
A.X 的同分异构体中,含单官能团的共 5 种
B.1mol X 最多能和 1mol H2 加成
C.表示丙醛燃烧热的热化学方程式为:C3H6O(l)+4O2(g) = 3CO2 (g)+3H2O(l) △H=+1815kJ/mol
D.X 的同分异构体其中之一 CH2=CHCH2OH 可以发生取代反应、加成反应、加聚反应、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的溶解平衡曲线如图所示,下列说法不正确的是( )
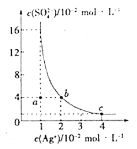
A.b点对应的Ksp(Ag2SO4)等于c点对应的Ksp(Ag2SO4)
B.采取蒸发溶剂的方法可以使a点对应的溶液变为b点对应的溶液
C.该温度下,Ksp(Ag2SO4)=1.6×10-5
D.0.02molL-1的AgNO3溶液与0.2molL-1的Na2SO4溶液等体积混合不会生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
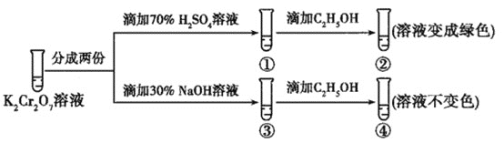
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下将pH均为a的氢氧化钠溶液和氢氧化钡溶液分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:b>c>a
B.常温下5.0×10-3mol·L-1KHA溶液的pH=3.75,该溶液中c(HA-)<c(A2-)
C.室温时,M(OH)2(s)![]() M2+(aq)+2OH-(aq)Ksp=a;c(M2+)=bmol·L-1时,溶液的pH等于14+
M2+(aq)+2OH-(aq)Ksp=a;c(M2+)=bmol·L-1时,溶液的pH等于14+![]() lg
lg![]()
D.Na2C2O4溶液:c(OH-)+2c(H2C2O4)=c(H+)+c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种清洁能源。工业上,常利用CO2和H2合成二甲醚。有关反应如下(z、y、z均大于0):
①2CH3OH(g)CH3OCH3(g)+H2O(g) △H1= -xkJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2= -ykJ·mol-1
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3= -zkJ·mol-1
(1)2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H= ___________kJ·mol-1
(2)下列有关合成二甲醚的说法正确的是 ___(填字母)。
a.增大压强能提高反应速率和CO2的平衡转化率
b.体系中减小![]() ,平衡一定向正方向移动
,平衡一定向正方向移动
c.容器体积一定,混合气体密度不变时一定达到平衡状态
d.充入适量CO,可能提高CH3OCH3的产率
(3)在一定温度下,在恒容密闭容器中发生反应:CO(g)+H2O(g)CO2(g)+H2(g),速率表达式为v=v正-v逆=k正c(CO)·c(H2O)-k逆c(CO2)·c(H2O)(其中,k正、k逆为正、逆速率常数,与浓度无关)。达到平衡时,升高温度,![]() 将_____选填“增大”“减小”或“不变”)。
将_____选填“增大”“减小”或“不变”)。
(4)在恒容密闭容器中用CO2和H2合成二甲醚时CO2的平衡转化率与温度、投料比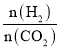 的关系如图所示。
的关系如图所示。
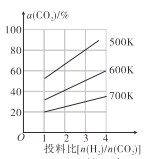
①500K时,将9mol H2和3mol CO2充入2L恒容密闭容器中,5min时反应达到平衡状态,则0~5min内的平均反应速率v(H2)=____________ molL-1min-l,该温度下,反应的平衡常数K=____(列出计算式即可,无需化简)。
②由图像可以得出的结论是_________(答两条)。
(5)工业上也可用CO和H2合成二甲醚,而且二者还能作燃料电池的燃料。以CO、H2体积比为1:2的混合气体与空气在KOH溶液中构成燃料电池(以石墨为电极),开始时,负极的电极反应式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com