
半导体工业用石英砂做原料通过三个重要反应生产单质硅
SiO2(s)+2C(s)=Si(s)+2CO(g) △H1=+682.44kJ·mol-1
(石英砂) (粗硅)
Si(s)+2C12(g)=SiCl4(l) △H2=一657.01kJ·mol-1
(粗硅)
SiCl4(l)+2Mg(s)=2MgCl2(s)+Si(s) △H3=一625.63kJ·mol-1
(纯硅)
若生产1.00kg纯硅放出的热量为
| A.21.44kJ | B.600.20kJ | C.21435.71kJ | D.1965.10kJ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)═CO2(g) ;△H1 C(s) +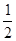 O2(g)═CO(g) ; △H2
O2(g)═CO(g) ; △H2
②S(s)+O2(g)═SO2(g) ;△H3 S(g) +O2(g)═SO2(g) ;△H4
③H2(g) +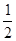 O2(g)═H2O(g);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(g);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8
| A.① | B.④ | C.①②③ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知反应 ①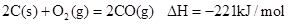
②稀溶液中,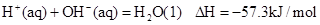 ,下列结论正确的是
,下列结论正确的是
| A.碳的燃烧热为110.5kJ/mol |
| B.2molC(s)+1molO2(g)的能量比2molCO(g)的能量高221kJ |
| C.0.5 molH2SO4(浓)与1 molNaOH溶液混合,产生57.3kJ热量 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ/mol |
| B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.Ba(OH)2·8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语错误的是 ( )
A.碳酸钠的水解反应:CO32-+H2O  HCO3-+OH- HCO3-+OH- |
B.FeCl3水解的离子方程式:Fe3++3H2O Fe (OH)3+3H+ Fe (OH)3+3H+ |
| C.稀溶液中强酸与强碱的中和热:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ· mol-1 |
| D.C燃烧的热化学方程式为:C(s)+1/2O2(g)=CO(g)△H = 110.5kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:
CH3OH(g) + H2O(g) → CO2(g) + 3H2(g) – 49.0 kJ
下列说法正确的是
| A.1 LCH3OH蒸汽与1 L水蒸汽反应生成1 L CO2气体与3 L氢气吸收热量49.0 kJ |
| B.1个CH3OH分子与1个水分子反应生成1个CO2分子与3个H2分子吸收49.0 kJ热量 |
| C.相同条件下1molCH3OH(g)与1mol H2O(g)的能量总和小于1molCO2(g)与3 mol H2(g)的能量总和 |
| D.1 molCH3OH蒸汽与1 mol液态水反应生成1mol CO2气体与3 mol 氢气吸收的热量小于49.0 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
能源是当今社会发展的三大支柱之一。有专家提出:如果能够利用太阳能使燃料燃烧产物,如CO2、H2O、N2等重新组合(如图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为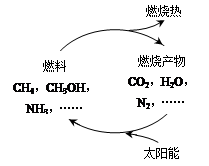
| A.化学能 | B.热能 |
| C.生物能 | D.电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中,正确的是 ( )
| A.室温下,pH=5.6的NaHSO3溶液中c( SO32-)-c( H2SO3)= 10-5.6-10-8.4 |
| B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| C.吸热反应只有在加热条件下才能发生,故水不加热不电离 |
| D.过量的氨水和盐酸反应所得溶液不可能为酸性,但可能为中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com