
【题目】(1)用a mol/L的盐酸滴定未知浓度的氢氧化钠溶液,用酚酞作指示剂,达到滴定终点的现象是___。
(2)硫代硫酸钠晶体(Na2S2O3.5H2O,M=248g/mol)可用作定影剂、还原剂。回答下列问题:
利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,配成100ml溶液 ②滴定:取0.0090mol/LK2Cr2O7的标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应K2Cr2O+6KI+7H2SO=Cr2(SO)+7H2O+3I+4K2SO,然后用硫代硫酸钠样品溶液滴定,发生反应:2Na2S2O3+I2=Na2S4O6+2NaI。加入淀粉溶液作为指示剂,继续滴定,到终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为___(保留1位小数)。
(3)已知:常温下,醋酸的电离平衡常数为1×10-6,则0.01mol/L的醋酸钠溶液的pH=___,水电离出的c(H+)=___。
【答案】滴入最后一滴标准盐酸溶液,溶液由红色变为无色,且半分钟内不变色 90.0% 9 1×10-5mol/L
【解析】
在醋酸钠溶液中,醋酸根离子发生水解,溶液中的OH-全部来自水电离;不管是酸溶液、碱溶液还是盐溶液,由水电离产生的c(OH-)、c(H+)一定相等。
(1)用a mol/L的盐酸滴定未知浓度的氢氧化钠溶液,用酚酞作指示剂,达到滴定终点时,盐酸过量一滴,溶液由红色变为无色,且在半分钟内不变色;
答案为:滴入最后一滴标准盐酸溶液,溶液由红色变为无色,且半分钟内不变色。
(2)设0.0090mol/LK2Cr2O7的标准溶液20.00mL,消耗Na2S2O3的物质的量为x
K2Cr2O7——3I——6Na2S2O3
1mol 6mol
0.0090mol/L×0.02L x
X=0.0090mol/L×0.02L×6=0.00108mol,
样品的纯度为: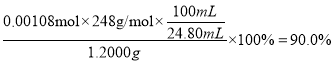 ,
,
答案:90.0%。
(3)设水解的c(CH3COO-)=y
CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
起始量 0.01mol/L 0 0
变化量 x x x
平衡量 0.01-x x x
Kh=![]() ,
,
因为x<<0.01,所以0.01-x≈0.01,
x=1×10-5mol/L,
pH=-lg![]() =9,
=9,
水电离产生的c(H+)=c(OH-)=1×10-5mol/L;
答案为:9;1×10-5mol/L。


科目:高中化学 来源: 题型:
【题目】分别将下列物质:①Al2(SO4)3②Na2CO3③KCl④CuCl2⑤FeSO4溶于水中,对其溶液加热蒸干,仍能得到原物质的是
A. ①③④⑤ B. ②④ C. ①②③ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用海水资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法不正确的是 ( )
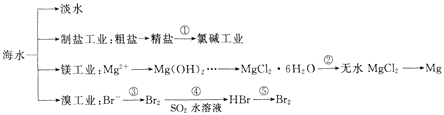
A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法
B.氯碱工业中采用阳离子交换膜可提高产品的纯度
C.由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D.溴工业中③、④的目的是富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 下列物质中,既含有极性共价键,又含有非极性共价键的是______
下列物质中,既含有极性共价键,又含有非极性共价键的是______
A.![]() B.
B.![]() C.
C.![]()
![]()
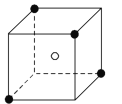
![]() 某离子晶体晶胞的结构如图1所示,
某离子晶体晶胞的结构如图1所示,![]() 位于立方体中心,
位于立方体中心,![]() 位于立方体顶点。该晶体的化学式为______
位于立方体顶点。该晶体的化学式为______
A.![]()
![]() C.
C.![]()
![]()
![]() 下列物质性质的变化规律与键能无关的是______
下列物质性质的变化规律与键能无关的是______
A.热稳性:![]()
B.熔、沸点:金刚石![]() 晶体硅
晶体硅
C.熔点:![]()
D.熔、沸点:![]()
![]() 、S、Se是同一主族元素,请回答下列问题:
、S、Se是同一主族元素,请回答下列问题:
![]() 、S、Se的电负性由大到小的顺序是______。
、S、Se的电负性由大到小的顺序是______。
![]() 是______分子
是______分子![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() ,中心原子的轨道杂化类型为______,
,中心原子的轨道杂化类型为______,![]() 分子的立体构型名称是______。
分子的立体构型名称是______。
![]() 的沸点高于
的沸点高于![]() 的沸点,其原因是______。
的沸点,其原因是______。
![]() 与
与![]() 分子互为等电子体的阴离子为______
分子互为等电子体的阴离子为______![]() 填化学式
填化学式![]() 。
。
![]() 已知Se原子比O原子多2个电子层,基态Se原子核外电子排布式为______,有______个未成对电子。
已知Se原子比O原子多2个电子层,基态Se原子核外电子排布式为______,有______个未成对电子。
![]() 离化合物
离化合物![]() 的晶胞如图所示,
的晶胞如图所示,![]() 的配位数是______;若阿伏加德罗常数值为
的配位数是______;若阿伏加德罗常数值为![]() ,晶胞参数为anm,列式计算晶体的密度
,晶胞参数为anm,列式计算晶体的密度![]() ______
______![]() 只列式,不用计算最后结果
只列式,不用计算最后结果![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金应用广泛,镍铜是重要的合金元素,如镧镍合金、铜镍合金、铝镍合金等。
![]() 基态铜原子的外围电子排布式为______,K和Cu属于同一周期,金属K的熔点比金属Cu______
基态铜原子的外围电子排布式为______,K和Cu属于同一周期,金属K的熔点比金属Cu______![]() 填“高”或“低”
填“高”或“低”![]() ,原因是______。
,原因是______。
![]() 在
在![]() 溶液中滴加稀氨水能形成配位化合物
溶液中滴加稀氨水能形成配位化合物![]() 。
。
![]() 、N、O、Ni的电负性由小到大的顺序为______;
、N、O、Ni的电负性由小到大的顺序为______;
![]() SO42-中S原子的杂化类型是______。
SO42-中S原子的杂化类型是______。
![]() SO42-与互为等电子体的分子的化学式
SO42-与互为等电子体的分子的化学式![]() 写出一种即可
写出一种即可![]() ______;
______;
![]() 工业上,采用反应
工业上,采用反应![]() 提纯粗镍。推测
提纯粗镍。推测![]() 晶体中存在的作用力有______。
晶体中存在的作用力有______。
![]() 非极性键
非极性键![]() 极性键
极性键![]() 范德华力
范德华力![]() 离子键
离子键![]() 配位键
配位键
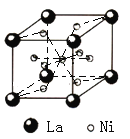
![]() 镧镍合金的晶胞如图1所示,镍原子除了1个在体心外,其余都在面上。该合金中镧原子和镍原子的个数比为______。
镧镍合金的晶胞如图1所示,镍原子除了1个在体心外,其余都在面上。该合金中镧原子和镍原子的个数比为______。
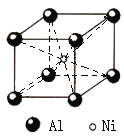
![]() 铝镍合金的晶胞如图所示。已知:铝镍合金的密度为
铝镍合金的晶胞如图所示。已知:铝镍合金的密度为![]() ,
,![]() 代表阿伏加德罗常数的数值,则镍、铝的最短核间距
代表阿伏加德罗常数的数值,则镍、铝的最短核间距![]() 为______。
为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在研究金矿床物质组分的过程中,通过分析发现了![]() 多金属互化物.
多金属互化物.
![]() 某金属互化物属于晶体,区别晶体和非晶体可通过 ______ 方法鉴别.该金属互化物原子在三维空间里呈周期性有序排列,即晶体具有 ______ 性.
某金属互化物属于晶体,区别晶体和非晶体可通过 ______ 方法鉴别.该金属互化物原子在三维空间里呈周期性有序排列,即晶体具有 ______ 性.
![]() 基态
基态![]() 的核外电子排布式 ______ ;配合物
的核外电子排布式 ______ ;配合物![]() 常温下为液态,易溶于
常温下为液态,易溶于![]() 、苯等有机溶剂.固态
、苯等有机溶剂.固态![]() 属于 ______ 晶体.
属于 ______ 晶体.
![]() 铜能与类卤素
铜能与类卤素![]() 反应生成
反应生成![]() 分子中含有
分子中含有![]() 键的数目为 ______ ;
键的数目为 ______ ;
类卤素![]() 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸![]() 的沸点低于异硫氰酸
的沸点低于异硫氰酸![]() 的沸点,其原因是 ______ ;
的沸点,其原因是 ______ ;
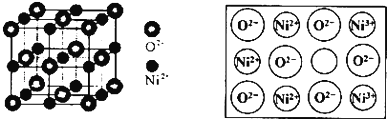
![]() 立方
立方![]() 氧化镍
氧化镍![]() 晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为 ______
晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为 ______ ![]() 不必计算出结果,阿伏加德罗常数的值为
不必计算出结果,阿伏加德罗常数的值为![]() 人工制备的NiO晶体中常存在缺陷
人工制备的NiO晶体中常存在缺陷![]() 如图 一个
如图 一个![]() 空缺,另有两个
空缺,另有两个![]() 被两个
被两个![]() 所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.已知某氧化镍样品组成
所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.已知某氧化镍样品组成![]() ,该晶体中
,该晶体中![]() 与
与![]() 的离子个数之比为 ______ .
的离子个数之比为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:KSP(BaSO4)=2×10-10,KSP(BaSO3)=2.5×10-7,现有一Na2SO4、Na2SO3的混合溶液,其中c(Na2SO3)=0.5mol/L,c(Na2SO4)=0.05mol/L。若向该溶液中加入等体积的0.5mol/LBaCl2溶液,充分反应后,溶液中c(Ba2+)=__(混合时溶液体积变化忽略不计)。若向该混合溶液中加BaCl2固体,当SO32-开始沉淀时,c(SO42-)=___;当SO42-沉淀完全时,c(SO32-)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g)![]() CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为______。
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
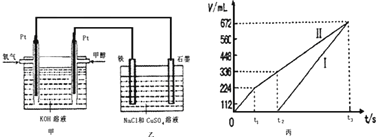
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为___________________________________。
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为1×10-3mol,则理论上生成的SO42-为_____________mol。
(4)写出甲中通入甲醇这一极的电极反应式______________________。
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________,原混合溶液中 NaCl的物质的量浓度为___________mol/L。(设溶液体积不变)
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_____________g。
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为_____________克。(已知1个电子所带电量为1.6×10-19C,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子能大量共存的是( )
A. 稀硫酸中:K+、Mg2+、A1O2-、S2O32-
B. KW/c(H+)=10-13 mol·L-1 的溶液中:Fe3+、NH4+、Mg2+、SO42-
C. 使甲基橙变红的溶液中:Fe2+、MnO4﹣、Na+、SO42﹣
D. 通入大量 CO2 的溶液中:Na+、ClO-、CH3COO-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com