
【题目】合金应用广泛,镍铜是重要的合金元素,如镧镍合金、铜镍合金、铝镍合金等。
![]() 基态铜原子的外围电子排布式为______,K和Cu属于同一周期,金属K的熔点比金属Cu______
基态铜原子的外围电子排布式为______,K和Cu属于同一周期,金属K的熔点比金属Cu______![]() 填“高”或“低”
填“高”或“低”![]() ,原因是______。
,原因是______。
![]() 在
在![]() 溶液中滴加稀氨水能形成配位化合物
溶液中滴加稀氨水能形成配位化合物![]() 。
。
![]() 、N、O、Ni的电负性由小到大的顺序为______;
、N、O、Ni的电负性由小到大的顺序为______;
![]() SO42-中S原子的杂化类型是______。
SO42-中S原子的杂化类型是______。
![]() SO42-与互为等电子体的分子的化学式
SO42-与互为等电子体的分子的化学式![]() 写出一种即可
写出一种即可![]() ______;
______;
![]() 工业上,采用反应
工业上,采用反应![]() 提纯粗镍。推测
提纯粗镍。推测![]() 晶体中存在的作用力有______。
晶体中存在的作用力有______。
![]() 非极性键
非极性键![]() 极性键
极性键![]() 范德华力
范德华力![]() 离子键
离子键![]() 配位键
配位键
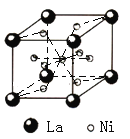
![]() 镧镍合金的晶胞如图1所示,镍原子除了1个在体心外,其余都在面上。该合金中镧原子和镍原子的个数比为______。
镧镍合金的晶胞如图1所示,镍原子除了1个在体心外,其余都在面上。该合金中镧原子和镍原子的个数比为______。
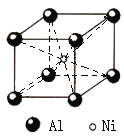
![]() 铝镍合金的晶胞如图所示。已知:铝镍合金的密度为
铝镍合金的晶胞如图所示。已知:铝镍合金的密度为![]() ,
,![]() 代表阿伏加德罗常数的数值,则镍、铝的最短核间距
代表阿伏加德罗常数的数值,则镍、铝的最短核间距![]() 为______。
为______。
【答案】![]() 低 K的原子半径大,价电子数少,金属键较弱
低 K的原子半径大,价电子数少,金属键较弱 ![]()
![]() 杂化
杂化 ![]() bce 1:5
bce 1:5 ![]()
【解析】
![]() 是29号元素,处于第四周期IB族,属于过渡元素,外围电子包括最外层电子与3d电子;原子半径越大、价电子越少,金属键越弱,金属晶体的熔点越低;
是29号元素,处于第四周期IB族,属于过渡元素,外围电子包括最外层电子与3d电子;原子半径越大、价电子越少,金属键越弱,金属晶体的熔点越低;
![]() 非金属性元素电负性大于金属元素的,同周期主族元素随原子序数增大电负性增大,N、O在它们的氢化物中均表现负化合价,它们的电负性均大于氢元素的;
非金属性元素电负性大于金属元素的,同周期主族元素随原子序数增大电负性增大,N、O在它们的氢化物中均表现负化合价,它们的电负性均大于氢元素的;
![]() 中S原子孤电子对数
中S原子孤电子对数![]() ,杂化轨道数目
,杂化轨道数目![]() ;
;
![]() 中含有5个原子、32个价电子,平均价电子数目为
中含有5个原子、32个价电子,平均价电子数目为![]() ,其等电子体的分子只能是价电子为7个4个原子与价电子为4个1个原子形成的分子;
,其等电子体的分子只能是价电子为7个4个原子与价电子为4个1个原子形成的分子;
![]() 晶体沸点很低,属于分子晶体,分子之间存在范德华力,
晶体沸点很低,属于分子晶体,分子之间存在范德华力,![]() 晶体中Ni与CO形成配位键,CO中原子之间形成极性键;
晶体中Ni与CO形成配位键,CO中原子之间形成极性键;
![]() 镍原子除了1个在体心外,其余都在面上,La处于晶胞顶点,均摊法计算晶胞中原子数目,确定原子数目之比;
镍原子除了1个在体心外,其余都在面上,La处于晶胞顶点,均摊法计算晶胞中原子数目,确定原子数目之比;
![]() 处于体对角线上的Al、Ni原子之间距离最近,二者距离等于晶胞体对角线长度的
处于体对角线上的Al、Ni原子之间距离最近,二者距离等于晶胞体对角线长度的![]() ,体对角线长度等于晶胞棱长的
,体对角线长度等于晶胞棱长的![]() 倍,均摊法计算晶胞中原子数目,计算晶胞质量,结合密度计算晶胞体积,晶胞体积开三次方得到晶胞棱长。
倍,均摊法计算晶胞中原子数目,计算晶胞质量,结合密度计算晶胞体积,晶胞体积开三次方得到晶胞棱长。
![]() 是29号元素,处于第四周期IB族,外围电子排布式为:
是29号元素,处于第四周期IB族,外围电子排布式为:![]() ,K的原子半径大,价电子数少,金属键较弱,故金属K的熔点比金属Cu的低,故答案为:
,K的原子半径大,价电子数少,金属键较弱,故金属K的熔点比金属Cu的低,故答案为:![]() ;低;K的原子半径大,价电子数少,金属键较弱;
;低;K的原子半径大,价电子数少,金属键较弱;
![]()
![]() 非金属性元素电负性大于金属元素的,同周期主族元素随原子序数增大电负性增大,N、O在它们的氢化物中均表现负化合价,它们的电负性均大于氢元素的,故电负性:
非金属性元素电负性大于金属元素的,同周期主族元素随原子序数增大电负性增大,N、O在它们的氢化物中均表现负化合价,它们的电负性均大于氢元素的,故电负性:![]() ,故答案为:
,故答案为:![]() ;
;
![]()
![]() 中S原子孤电子对数
中S原子孤电子对数![]() ,杂化轨道数目
,杂化轨道数目![]() ,S原子杂化方式为:
,S原子杂化方式为:![]() 杂化,故答案为:
杂化,故答案为:![]() 杂化;
杂化;
![]()
![]() 中含有5个原子、32个价电子,平均价电子数目为
中含有5个原子、32个价电子,平均价电子数目为![]() ,其等电子体的分子只能是价电子为7个4个原子与价电子为4个1个原子形成的分子,可能的等电子体分子式为:
,其等电子体的分子只能是价电子为7个4个原子与价电子为4个1个原子形成的分子,可能的等电子体分子式为:![]() 等,故答案为:
等,故答案为:![]() ;
;
![]()
![]() 晶体沸点很低,属于分子晶体,分子之间存在范德华力,
晶体沸点很低,属于分子晶体,分子之间存在范德华力,![]() 晶体中Ni与CO形成配位键,CO中原子之间形成极性键,没有非金属性与离子键,故答案为:bce;
晶体中Ni与CO形成配位键,CO中原子之间形成极性键,没有非金属性与离子键,故答案为:bce;
![]() 镍原子除了1个在体心外,其余都在面上,晶胞中Ni原子数目
镍原子除了1个在体心外,其余都在面上,晶胞中Ni原子数目![]() ,La处于晶胞顶点,晶胞中La原子数目
,La处于晶胞顶点,晶胞中La原子数目![]() ,该合金中镧原子和镍原子的个数比为1:5,故答案为:1:5;
,该合金中镧原子和镍原子的个数比为1:5,故答案为:1:5;
![]() 处于体对角线上的Al、Ni原子之间距离最近,二者距离等于晶胞体对角线长度的
处于体对角线上的Al、Ni原子之间距离最近,二者距离等于晶胞体对角线长度的![]() ,体对角线长度等于晶胞棱长的
,体对角线长度等于晶胞棱长的![]() 倍,晶胞中Al原子数目
倍,晶胞中Al原子数目![]() 、Ni原子数目
、Ni原子数目![]() ,故晶胞质量
,故晶胞质量![]() ,晶胞体积
,晶胞体积![]() ,晶胞棱长
,晶胞棱长![]() ,故镍、铝的最短核间距
,故镍、铝的最短核间距![]() ,
,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】如图①Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置,Ⅳ、Ⅴ、Ⅵ是气体收集装置。根据要求回答下列问题: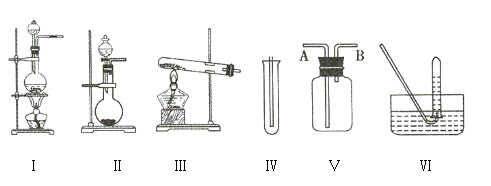
(1)若用![]() 与浓盐酸反应制取氯气,应选用装置 ___________________ 。
与浓盐酸反应制取氯气,应选用装置 ___________________ 。
(2)若用![]() 与浓盐酸反应制取氯气,应选用装置 ___________________ ,试完成并配平下列离子方程式:
与浓盐酸反应制取氯气,应选用装置 ___________________ ,试完成并配平下列离子方程式:
___________________ ![]() + ___________________
+ ___________________ ![]() + ___________________
+ ___________________ ![]() ___________________
___________________ ![]() + ___________________
+ ___________________ ![]() + ___________________ 。
+ ___________________ 。
(3)若选用装置Ⅳ为氯气的收集装置,则应该在试管口中放置一团棉花,该棉花团需用 ___________________ 溶液浸润,其作用是 ___________________ 。
(4)若选用装置Ⅴ为氯气的收集装置,则氯气应从 ___________________ (填“A”或“B”)口通入,利用化学原理检验氯气已收集满的方法是 ___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2H→H2放出437.6 kJ的热量,下列说法正确的是_______
A. 氢气分子内每个氢原子都达到稳定结构
B. 氢气分子的能量比两个氢原子的能量低
C. 1 mol H2 离解成 2 mol H 要放出437.6 kJ热量
D. 氢原子比氢气分子稳定
(2)已知原电池的总反应式:Cu + 2FeCl3 = CuCl2 + 2FeCl2,请写出电极反应方程式:
负极___________________________________
正极___________________________________
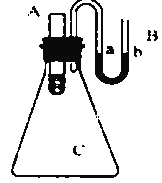
(3)如图所示,在锥形瓶放置装有水的小试管,往小试管中分别加入下列物质:①烧碱固体 ②浓硫酸 ③硝酸铵固体④NaCl固体,其中能使a端液面高于b端液面的是_______________。(填序号)
(4)科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术2H2O![]() 2H2↑+O2↑。制得的氢气可用于制作燃料电池.试回答下列问题:
2H2↑+O2↑。制得的氢气可用于制作燃料电池.试回答下列问题:
①分解海水时,实现了光能转化为______能;生成的氢气用于制作燃料电池时,实现了化学能转化为______能;分解海水的反应属于______反应(填“放热”或“吸热”)。
②某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为:2H2 + 2O24e=2H2O,则A极是电池的______极,电子从该极______(填“流入”或“流出”),B极的电极反应式为:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)。图甲表示在此反应过程中的能量的变化,图乙表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图丙表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图甲表示在此反应过程中的能量的变化,图乙表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图丙表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
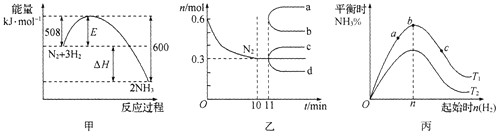
下列说法正确的是 ( )
A.升高温度,该反应的平衡常数增大
B.由图乙信息,从11 min起其他条件不变,压缩容器的体积,则n(N2)的变化曲线为d
C.由图乙信息,10 min内该反应的平均速度v(H2) = 0. 09 mol·L-l·min-l
D.图丙中温度T1 < T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是油与脂肪的总称,它是多种高级脂肪酸的甘油酯。油脂既是重要食物,又是重要的化工原料。油脂的以下用途与其含有的碳碳不饱和键(![]() )有关的是
)有关的是
A. 衣服上的油脂可用汽油洗去
B. 适量摄入油脂,有利于人体吸收多种脂溶性维生素和胡萝卜素
C. 植物油通过氢化可以制造植物奶油(人造奶油)
D. 脂肪是有机体组织里储存能量的重要物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用a mol/L的盐酸滴定未知浓度的氢氧化钠溶液,用酚酞作指示剂,达到滴定终点的现象是___。
(2)硫代硫酸钠晶体(Na2S2O3.5H2O,M=248g/mol)可用作定影剂、还原剂。回答下列问题:
利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,配成100ml溶液 ②滴定:取0.0090mol/LK2Cr2O7的标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应K2Cr2O+6KI+7H2SO=Cr2(SO)+7H2O+3I+4K2SO,然后用硫代硫酸钠样品溶液滴定,发生反应:2Na2S2O3+I2=Na2S4O6+2NaI。加入淀粉溶液作为指示剂,继续滴定,到终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为___(保留1位小数)。
(3)已知:常温下,醋酸的电离平衡常数为1×10-6,则0.01mol/L的醋酸钠溶液的pH=___,水电离出的c(H+)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素有着多变价态和种类繁多的化合物,在工农业生产中有重要的应用。
![]() 同周期元素中,比氮元素的第一电离能大的元素共有________种。
同周期元素中,比氮元素的第一电离能大的元素共有________种。
![]() 与汞共热可制得
与汞共热可制得![]() 。
。
![]() 的几何构型为________,
的几何构型为________,![]() 中
中![]() 键和
键和![]() 键的个数比为________。
键的个数比为________。
![]() 已知汞位于第六周期,与锌同族。基态汞原子的价电子排布式为______。
已知汞位于第六周期,与锌同族。基态汞原子的价电子排布式为______。
![]() 分子中B原子的杂化轨道类型为_______,该分子的熔沸点比乙烷高,原因是________________。
分子中B原子的杂化轨道类型为_______,该分子的熔沸点比乙烷高,原因是________________。
![]() 由B、N、F元素组成的离子化合物中,B、N、F原子的个数比为
由B、N、F元素组成的离子化合物中,B、N、F原子的个数比为![]() ,其阴阳离子是等电子体,该化合物中的阴离子是________
,其阴阳离子是等电子体,该化合物中的阴离子是________![]() 填离子符号
填离子符号![]() 。
。
![]() 氮化硼晶体结构如图所示:
氮化硼晶体结构如图所示:
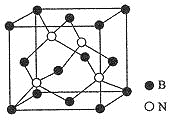
![]() 该晶体中含有的微粒间作用力为________。
该晶体中含有的微粒间作用力为________。
![]() 图中N原子的坐标参数为
图中N原子的坐标参数为![]() ;
;![]() ;
;![]() ;________。
;________。
![]() 已知BN晶胞中相邻且最近的硼、氮原子的核间距为acm,
已知BN晶胞中相邻且最近的硼、氮原子的核间距为acm,![]() 为阿伏加德罗常数的值,其密度为________
为阿伏加德罗常数的值,其密度为________![]() 列出计算式即可
列出计算式即可![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是
A.容量瓶用蒸馏水洗净后,需经干燥再用于配制溶液
B.用Na2CO310H2O晶体配制Na2CO3溶液时,Na2CO3晶体已失去部分结晶水,用该晶体所配Na2CO3溶液的物质的量浓度偏大
C.配制NaOH溶液时,NaOH固体中含有Na2O杂质,所配溶液物质的量浓度偏小
D.定容时,为防止液滴飞溅,胶头滴管紧贴容量瓶内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关①100mL 0.1 mol/L![]() 、②100mL 0.1 mol/L
、②100mL 0.1 mol/L![]() 两种溶液的叙述不正确的是
两种溶液的叙述不正确的是
A.溶液中水电离出的![]() 个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:![]() D.②溶液中:
D.②溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com