
【题目】如图①Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置,Ⅳ、Ⅴ、Ⅵ是气体收集装置。根据要求回答下列问题: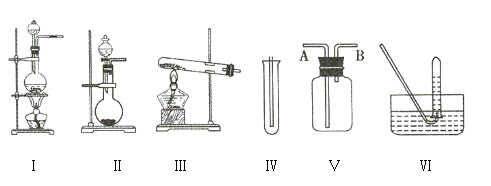
(1)若用![]() 与浓盐酸反应制取氯气,应选用装置 ___________________ 。
与浓盐酸反应制取氯气,应选用装置 ___________________ 。
(2)若用![]() 与浓盐酸反应制取氯气,应选用装置 ___________________ ,试完成并配平下列离子方程式:
与浓盐酸反应制取氯气,应选用装置 ___________________ ,试完成并配平下列离子方程式:
___________________ ![]() + ___________________
+ ___________________ ![]() + ___________________
+ ___________________ ![]() ___________________
___________________ ![]() + ___________________
+ ___________________ ![]() + ___________________ 。
+ ___________________ 。
(3)若选用装置Ⅳ为氯气的收集装置,则应该在试管口中放置一团棉花,该棉花团需用 ___________________ 溶液浸润,其作用是 ___________________ 。
(4)若选用装置Ⅴ为氯气的收集装置,则氯气应从 ___________________ (填“A”或“B”)口通入,利用化学原理检验氯气已收集满的方法是 ___________________ 。
【答案】Ⅰ II 2 10 16 2 5 ![]() 氢氧化钠 防止氯气逸出污染空气 A 将湿润的淀粉KI试纸放在B口处,若试纸变蓝色,则证明氯气已收集满
氢氧化钠 防止氯气逸出污染空气 A 将湿润的淀粉KI试纸放在B口处,若试纸变蓝色,则证明氯气已收集满
【解析】
(1)二氧化锰和浓盐酸的反应是固液混合加热型,所以选择Ⅰ装置;
(2)高锰酸钾与浓盐酸不需要加热即可制备氯气,所以选择装置II制备;反应中KMnO4+→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(3)氯气有毒,直接排放能够引起空气污染,氯气能够与碱反应,可以用氢氧化钠溶液吸收,所以若选用Ⅳ为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用氢氧化钠溶液浸湿,其作用是吸收过量氯气,防止空气污染;
(4)氯气密度大于空气密度,应选择向上排气法收集,若选用Ⅴ为氯气收集装置,应长进短出,即从A口入;氯气具有氧化性能氧化碘离子生成单质碘,碘遇到淀粉变蓝,所以将湿润的淀粉KI试纸放在B口处,若试纸变蓝色,则证明氯气已收集满。


科目:高中化学 来源: 题型:
【题目】在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
(1)该反应的平衡常数表达式为K=________。
(2)该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的平均反应速率为________。
(3)该反应达到平衡后,加入Fe粉,平衡________移动;保持恒温恒容通入CO,平衡向________移动。(填“向左”、“向右”或“不”)
(4)表明该反应已达平衡状态的是______________
A.单位时间内生成nmolCO同时生成nmolCO2 B.恒容时混合气体的压强不变
C.混合气体的总质量不变 D.CO2的体积分数不变 E.Fe的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H =-a kJ·mol-1 (a > 0),其反应机理如下:①NO(g)+Br2(g)
2NOBr(g) △H =-a kJ·mol-1 (a > 0),其反应机理如下:①NO(g)+Br2(g)![]() NOBr2 (g)快②NO(g)+NOBr2(g)
NOBr2 (g)快②NO(g)+NOBr2(g)![]() 2NOBr(g)慢,下列有关该反应的说法正确的是 ( )
2NOBr(g)慢,下列有关该反应的说法正确的是 ( )
A.该反应的速率主要取决于①的快慢
B.NOBr2是该反应的催化剂
C.正反应的活化能比逆反应的活化能小a kJ·mol-1
D.增大Br2 (g)浓度能增大单位体积内活化分子百分数,加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为![]() ,他们设计如下实验用于制取氯气并验证其性质。
,他们设计如下实验用于制取氯气并验证其性质。
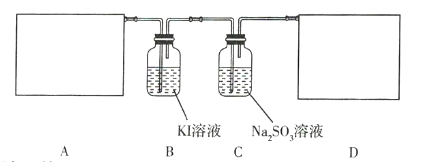
请回答下列问题。
(1)该实验中A部分的装置是 _________________________________ (填序号)。
(2)B中的实验现象为 _____________________________。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因: _____________________________。请你帮助他们设计一个实验,证明C中的亚硫酸钠已被氧化: _____________________________(简述实验步骤)。
(4)请根据题意画出D处的实验装置图,并注明装置中盛放的物质__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝钠![]() 是有机合成中的重要还原剂,其合成路线如图所示。
是有机合成中的重要还原剂,其合成路线如图所示。
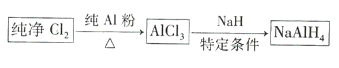
某实验小组利用如图所示的装置制备无水![]() 。
。
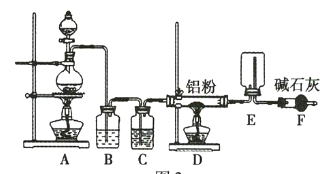
(1)装置F的作用是 _____________________________ 。
(2)![]() 与NaH反应时,需将
与NaH反应时,需将![]() 溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
(3)利用氢化铝钠遇水反应生成的氢气的体积测定氢化铝钠样品的纯度。
①其反应的化学方程式为 _____________________________
②设计如图四种装置测定氢化铝钠样品的纯度(假设杂质不参与反应)。
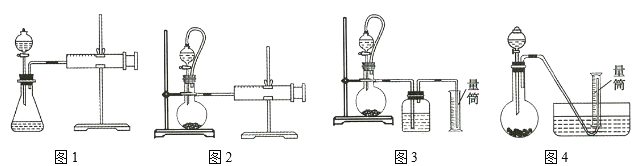
从简约性、准确性角度考虑,最适宜的装置是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别将下列物质:①Al2(SO4)3②Na2CO3③KCl④CuCl2⑤FeSO4溶于水中,对其溶液加热蒸干,仍能得到原物质的是
A. ①③④⑤ B. ②④ C. ①②③ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,几种难溶电解质的溶度积(Ksp):
化学式 | Mg(OH)2 | MgF2 | Fe(OH)3 | AgCl | Cu(OH)2 | Ag2CrO4 |
溶度积 | 5.6×10-12 | 7.4×10-11 | 4 .0×10-38 | 1.8×10-10 | 2.2×10-20 | 2.0×10-12 |
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SF6 是一种优良的绝缘气体,分子结构中只有S─F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F─F 、S─F键需吸收的能量分别为160 kJ、330 kJ。则1 mol 固体硫单质参加:S(s)+3F2(g)=SF6(g)反应,完全生成SF6(g)的热效应为( )
A. 吸收430 kJ B. 释放450 kJ
C. 释放1220 kJ D. 释放1780 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金应用广泛,镍铜是重要的合金元素,如镧镍合金、铜镍合金、铝镍合金等。
![]() 基态铜原子的外围电子排布式为______,K和Cu属于同一周期,金属K的熔点比金属Cu______
基态铜原子的外围电子排布式为______,K和Cu属于同一周期,金属K的熔点比金属Cu______![]() 填“高”或“低”
填“高”或“低”![]() ,原因是______。
,原因是______。
![]() 在
在![]() 溶液中滴加稀氨水能形成配位化合物
溶液中滴加稀氨水能形成配位化合物![]() 。
。
![]() 、N、O、Ni的电负性由小到大的顺序为______;
、N、O、Ni的电负性由小到大的顺序为______;
![]() SO42-中S原子的杂化类型是______。
SO42-中S原子的杂化类型是______。
![]() SO42-与互为等电子体的分子的化学式
SO42-与互为等电子体的分子的化学式![]() 写出一种即可
写出一种即可![]() ______;
______;
![]() 工业上,采用反应
工业上,采用反应![]() 提纯粗镍。推测
提纯粗镍。推测![]() 晶体中存在的作用力有______。
晶体中存在的作用力有______。
![]() 非极性键
非极性键![]() 极性键
极性键![]() 范德华力
范德华力![]() 离子键
离子键![]() 配位键
配位键
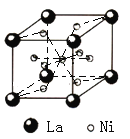
![]() 镧镍合金的晶胞如图1所示,镍原子除了1个在体心外,其余都在面上。该合金中镧原子和镍原子的个数比为______。
镧镍合金的晶胞如图1所示,镍原子除了1个在体心外,其余都在面上。该合金中镧原子和镍原子的个数比为______。
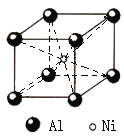
![]() 铝镍合金的晶胞如图所示。已知:铝镍合金的密度为
铝镍合金的晶胞如图所示。已知:铝镍合金的密度为![]() ,
,![]() 代表阿伏加德罗常数的数值,则镍、铝的最短核间距
代表阿伏加德罗常数的数值,则镍、铝的最短核间距![]() 为______。
为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com