
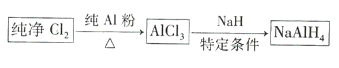
【题目】氢化铝钠![]() 是有机合成中的重要还原剂,其合成路线如图所示。
是有机合成中的重要还原剂,其合成路线如图所示。
某实验小组利用如图所示的装置制备无水![]() 。
。
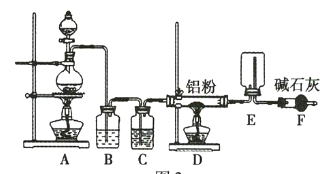
(1)装置F的作用是 _____________________________ 。
(2)![]() 与NaH反应时,需将
与NaH反应时,需将![]() 溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
(3)利用氢化铝钠遇水反应生成的氢气的体积测定氢化铝钠样品的纯度。
①其反应的化学方程式为 _____________________________
②设计如图四种装置测定氢化铝钠样品的纯度(假设杂质不参与反应)。
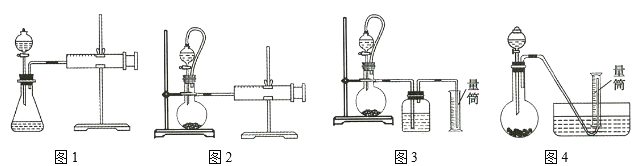
从简约性、准确性角度考虑,最适宜的装置是___________。
【答案】吸收未反应的![]() ,并防止空气中的水蒸气进入装置E NaH是离子化合物,难溶于有机溶剂,使反应物难以充分接触(或其他合理答案)
,并防止空气中的水蒸气进入装置E NaH是离子化合物,难溶于有机溶剂,使反应物难以充分接触(或其他合理答案) ![]() ②
②
【解析】
装置A中利用浓盐酸和二氧化锰固体共热制取氯气,B装置中盛放饱和食盐水除去氯气中的HCl气体,装置C对气体进行干燥,装置D中氯气与铝反应制取AlCl3,在装置E中凝华收集AlCl3,装置F对尾气进行处理,同时可以防止空气中的水蒸气进入装置E。
(1)该实验要制备无水AlCl3,需要整个装置中干燥,且氯气有毒未反应的氯气需要处理,所以装置F的作用为吸收未反应的Cl2,并防止空气中的水蒸气进入装置E;
(2)NaH是离子化合物,难溶于有机溶剂,使反应物难以充分接触,所以转化率较低;
(3)①氢化铝钠遇水反应生成的氢气,该过程为氢元素的归中氧化还原反应,其他元素的化合价不发生改变,所以方程式为![]() ;
;
②该实验通过测定铝氢化钠与水反应生成的氢气的量计算铝氢化钠的量,图1为封闭体系,装置内压强会升高,分液漏斗内液体无法顺利滴下;图3采用欲采用排水法收集,盛水的集气瓶长进短出无法实现排水收集;图4采用排水法收集气体,由于导管中会有气体残留以及液体的压力导致氢气体积的误差较大,且未采用恒压漏斗,液体可能会无法顺利滴下,综合考虑图2装置最适宜,采用恒压漏斗可使漏斗中液体顺利滴下,排空气法可避免导管中的残留气体。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H++OH-,向右移动且溶液呈酸性的是 ( )
H++OH-,向右移动且溶液呈酸性的是 ( )
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液
D.将水加热到100℃,使pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A由三种元素组成。M是单质,空气的主要成分之一。B是一种固体单质,组成该物质的元素在A中的质量分数约为![]() 。C、D均由两种元素组成,C中两元素同主族。I是一种建筑用的黏合剂。各物质之间的转化关系如图:
。C、D均由两种元素组成,C中两元素同主族。I是一种建筑用的黏合剂。各物质之间的转化关系如图:
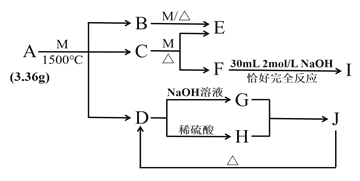
请回答:
![]() 中所含元素是_____________
中所含元素是_____________![]() 填元素名称
填元素名称![]() 。
。
![]() 与M反应的化学方程式为_______________________________________。
与M反应的化学方程式为_______________________________________。
![]() 写出
写出![]() 的离子方程式___________________________________________。
的离子方程式___________________________________________。
![]() 请设计实验方案证明E可能的成分___________________________________________。
请设计实验方案证明E可能的成分___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的甲、乙、丙、丁代表化学中常见的四种物质,其中甲、乙、丙均含有同一种元素。相互转化的关系如下,请回答下列问题。
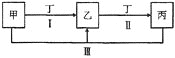
(1)甲气体的水溶液能使酚酞变红,乙为空气中含量最大的气体,写出反应![]() Ⅲ
Ⅲ![]() 的化学方程式:________________________________。
的化学方程式:________________________________。
(2)常温下![]() 的丁溶液pH为13,其焰色反应为黄色。甲、乙、丙为均含有同一种金属元素的无机化合物,反应
的丁溶液pH为13,其焰色反应为黄色。甲、乙、丙为均含有同一种金属元素的无机化合物,反应![]() Ⅲ
Ⅲ![]() 的离子方程式为___________________________________。
的离子方程式为___________________________________。
(3)若乙为淡黄色非金属单质,则反应![]() Ⅲ
Ⅲ![]() 中氧化产物与还原产物的物质的量之比为______________,
中氧化产物与还原产物的物质的量之比为______________,![]() 甲与含
甲与含![]() 的溶液充分反应后溶液呈碱性,溶液中所含乙元素的相关离子浓度的大小关系为________________。
的溶液充分反应后溶液呈碱性,溶液中所含乙元素的相关离子浓度的大小关系为________________。
(4)若甲、乙、丙的溶液均显碱性,丁为温室效应主要气体。浓度相同的乙、丙溶液pH较大的是______________![]() 填溶质的化学式
填溶质的化学式![]() 溶液,原因是______________________________。
溶液,原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学镀是指使用合适的还原剂,使镀液中的金属离子还原成金属而沉积在镀件表面上的一种镀覆工艺。化学镀广泛用作金属、塑料、玻璃、陶瓷等许多材料的装饰和防护。在ABS工程塑料表面进行化学镀镍的流程如下:
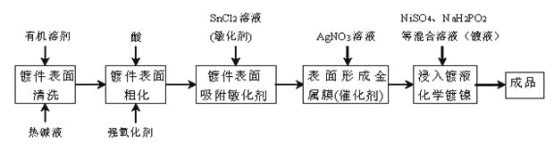
回答下列问题:
(1)化学镀与电镀比较,优点之一是_________。
(2)镀件表面用热碱液清洗的作用是_________,镀件表面粗化的目的是增强亲水性及_________。
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是_________。
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是_________。
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如下表所示:

由此推断,镀层厚度y与反应时间t的关系式为_________;欲使镀层厚度为6anm,需要的反应时间为_________。
(6)化学镀镍废液中含有Ni2+等污染物,需转化为沉淀除去。已知25℃,Ksp[Ni(OH)2]=2.0×10-15。若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为_________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图①Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置,Ⅳ、Ⅴ、Ⅵ是气体收集装置。根据要求回答下列问题: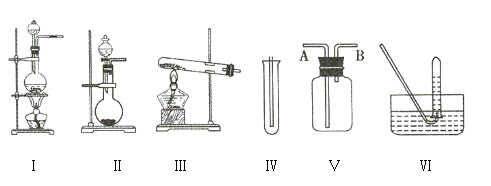
(1)若用![]() 与浓盐酸反应制取氯气,应选用装置 ___________________ 。
与浓盐酸反应制取氯气,应选用装置 ___________________ 。
(2)若用![]() 与浓盐酸反应制取氯气,应选用装置 ___________________ ,试完成并配平下列离子方程式:
与浓盐酸反应制取氯气,应选用装置 ___________________ ,试完成并配平下列离子方程式:
___________________ ![]() + ___________________
+ ___________________ ![]() + ___________________
+ ___________________ ![]() ___________________
___________________ ![]() + ___________________
+ ___________________ ![]() + ___________________ 。
+ ___________________ 。
(3)若选用装置Ⅳ为氯气的收集装置,则应该在试管口中放置一团棉花,该棉花团需用 ___________________ 溶液浸润,其作用是 ___________________ 。
(4)若选用装置Ⅴ为氯气的收集装置,则氯气应从 ___________________ (填“A”或“B”)口通入,利用化学原理检验氯气已收集满的方法是 ___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)![]() 3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
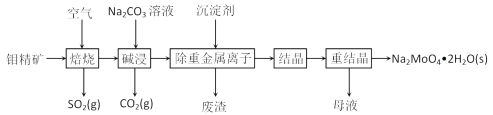
(1)提高焙烧效率的方法有:_____________(写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________。氧化产物是________________。
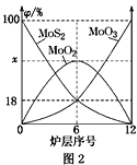
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为 ______________________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20molL1,c(SO42-)=0.01molL1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________。〔已知Ksp(BaSO4)=1×1010,Ksp(BaMoO4)=2.0×108〕
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是油与脂肪的总称,它是多种高级脂肪酸的甘油酯。油脂既是重要食物,又是重要的化工原料。油脂的以下用途与其含有的碳碳不饱和键(![]() )有关的是
)有关的是
A. 衣服上的油脂可用汽油洗去
B. 适量摄入油脂,有利于人体吸收多种脂溶性维生素和胡萝卜素
C. 植物油通过氢化可以制造植物奶油(人造奶油)
D. 脂肪是有机体组织里储存能量的重要物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com