
【题目】下图中的甲、乙、丙、丁代表化学中常见的四种物质,其中甲、乙、丙均含有同一种元素。相互转化的关系如下,请回答下列问题。
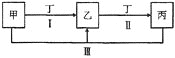
(1)甲气体的水溶液能使酚酞变红,乙为空气中含量最大的气体,写出反应![]() Ⅲ
Ⅲ![]() 的化学方程式:________________________________。
的化学方程式:________________________________。
(2)常温下![]() 的丁溶液pH为13,其焰色反应为黄色。甲、乙、丙为均含有同一种金属元素的无机化合物,反应
的丁溶液pH为13,其焰色反应为黄色。甲、乙、丙为均含有同一种金属元素的无机化合物,反应![]() Ⅲ
Ⅲ![]() 的离子方程式为___________________________________。
的离子方程式为___________________________________。
(3)若乙为淡黄色非金属单质,则反应![]() Ⅲ
Ⅲ![]() 中氧化产物与还原产物的物质的量之比为______________,
中氧化产物与还原产物的物质的量之比为______________,![]() 甲与含
甲与含![]() 的溶液充分反应后溶液呈碱性,溶液中所含乙元素的相关离子浓度的大小关系为________________。
的溶液充分反应后溶液呈碱性,溶液中所含乙元素的相关离子浓度的大小关系为________________。
(4)若甲、乙、丙的溶液均显碱性,丁为温室效应主要气体。浓度相同的乙、丙溶液pH较大的是______________![]() 填溶质的化学式
填溶质的化学式![]() 溶液,原因是______________________________。
溶液,原因是______________________________。
【答案】![]()
![]()
![]() Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓ ![]()
![]()
![]() 浓度相同的条件下,碳酸钠的水解程度大于碳酸氢钠的水解程度
浓度相同的条件下,碳酸钠的水解程度大于碳酸氢钠的水解程度
【解析】
满足上述关系的元素化合物可以是氮及其化合物,硫及其化合物,钠及其化合物,铝及其化合物的相互转化,根据元素及其化合物的性质答题。
(1)甲气体的水溶液能使酚酞变红,则甲为氨气,乙为空气中含量最大的气体,则乙为氮气,可推知丁为![]() ,则丙为NO,反应
,则丙为NO,反应![]() Ⅲ
Ⅲ![]() 的化学方程式为
的化学方程式为![]()
![]()
![]() ;
;
(2)常温下![]() 的丁溶液pH为13,其焰色反应为黄色,可推知丁为NaOH,甲、乙、丙为均含有同一种金属元素的无机化合物,由反应特点可知甲为
的丁溶液pH为13,其焰色反应为黄色,可推知丁为NaOH,甲、乙、丙为均含有同一种金属元素的无机化合物,由反应特点可知甲为![]() ,乙为
,乙为![]() ,丙为
,丙为![]() ,反应
,反应![]() Ⅲ
Ⅲ![]() 的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓;
的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)若乙为淡黄色非金属单质,可知乙为S,由反应特点可知甲为![]() ,丁为
,丁为![]() ,丙为
,丙为![]() ,反应Ⅲ方程式为
,反应Ⅲ方程式为![]() ,氧化产物与还原产物的物质的量之比为
,氧化产物与还原产物的物质的量之比为![]() ,
,![]() 甲与含
甲与含![]() 的溶液充分反应后所得溶液为NaHS溶液,呈碱性,说明硫氢根离子的水解程度大于电离程度,由于水解很微弱,则溶液中所含S元素的相关离子浓度的大小关系为
的溶液充分反应后所得溶液为NaHS溶液,呈碱性,说明硫氢根离子的水解程度大于电离程度,由于水解很微弱,则溶液中所含S元素的相关离子浓度的大小关系为![]() ;
;
(4)丁为温室效应主要气体可推知丁为![]() 。若甲、乙、丙的溶液均显碱性,则甲为NaOH,乙为
。若甲、乙、丙的溶液均显碱性,则甲为NaOH,乙为![]() ,丙为
,丙为![]() ,浓度相同的
,浓度相同的![]() 和
和![]() 溶液,pH较大的是
溶液,pH较大的是![]() ,浓度相同的条件下,碳酸钠的水解程度大于碳酸氢钠的水解程度。
,浓度相同的条件下,碳酸钠的水解程度大于碳酸氢钠的水解程度。


科目:高中化学 来源: 题型:
【题目】某实验探究小组研究320K时![]() 的分解反应:
的分解反应:![]() 。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
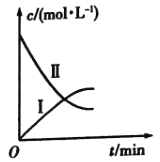
t/min | 0 | 1 | 2 | 3 | 4 |
| 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
| 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.曲线Ⅰ是![]() 的浓度变化曲线
的浓度变化曲线
B.曲线Ⅱ是![]() 的浓度变化曲线
的浓度变化曲线
C.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
D.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂亚硫酰氯(Li/SOCl2)电池是实际应用电池系列中比能量最高的一种电池,剖视图如图所示,一种非水的LiAlCl4的SOCl2溶液为电解液。亚硫酸氯既是电解质,又是正极活性物质,其中碳电极区的电极反应式为2SOCl2+4e-=4Cl-+S+SO2↑,该电池工作时,下列说法错误的是( )

A. 锂电极区发生的电极反应:Li-e-=Li+
B. 放电时发生的总反应:4Li+2SOCl2=4LiCl+SO2↑+S
C. 锂电极上的电势比碳电极上的低
D. 若采用水溶液代替SOCl2溶液,电池总反应和效率均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H =-a kJ·mol-1 (a > 0),其反应机理如下:①NO(g)+Br2(g)
2NOBr(g) △H =-a kJ·mol-1 (a > 0),其反应机理如下:①NO(g)+Br2(g)![]() NOBr2 (g)快②NO(g)+NOBr2(g)
NOBr2 (g)快②NO(g)+NOBr2(g)![]() 2NOBr(g)慢,下列有关该反应的说法正确的是 ( )
2NOBr(g)慢,下列有关该反应的说法正确的是 ( )
A.该反应的速率主要取决于①的快慢
B.NOBr2是该反应的催化剂
C.正反应的活化能比逆反应的活化能小a kJ·mol-1
D.增大Br2 (g)浓度能增大单位体积内活化分子百分数,加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:①N2(g)+2O2(g)=N2O4(g)ΔH=+8.7kJ·mol-1;②N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-534.0kJ·mol-1;下列表示肼跟N2O4反应的热化学方程式正确的是
A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-542.7kJ·mol-1
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1059.3kJ·mol-1
C.N2H4(g)+![]() N2O4(g)=
N2O4(g)=![]() N2(g)+2H2O(g)ΔH=-1076.7kJ·mol-1
N2(g)+2H2O(g)ΔH=-1076.7kJ·mol-1
D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1076.7kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为![]() ,他们设计如下实验用于制取氯气并验证其性质。
,他们设计如下实验用于制取氯气并验证其性质。
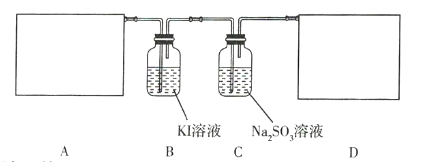
请回答下列问题。
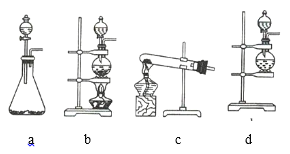
(1)该实验中A部分的装置是 _________________________________ (填序号)。
(2)B中的实验现象为 _____________________________。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因: _____________________________。请你帮助他们设计一个实验,证明C中的亚硫酸钠已被氧化: _____________________________(简述实验步骤)。
(4)请根据题意画出D处的实验装置图,并注明装置中盛放的物质__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝钠![]() 是有机合成中的重要还原剂,其合成路线如图所示。
是有机合成中的重要还原剂,其合成路线如图所示。
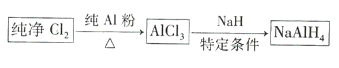
某实验小组利用如图所示的装置制备无水![]() 。
。
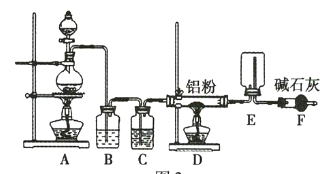
(1)装置F的作用是 _____________________________ 。
(2)![]() 与NaH反应时,需将
与NaH反应时,需将![]() 溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
(3)利用氢化铝钠遇水反应生成的氢气的体积测定氢化铝钠样品的纯度。
①其反应的化学方程式为 _____________________________
②设计如图四种装置测定氢化铝钠样品的纯度(假设杂质不参与反应)。
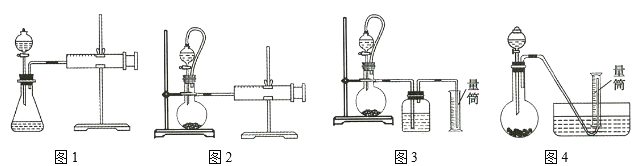
从简约性、准确性角度考虑,最适宜的装置是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,几种难溶电解质的溶度积(Ksp):
化学式 | Mg(OH)2 | MgF2 | Fe(OH)3 | AgCl | Cu(OH)2 | Ag2CrO4 |
溶度积 | 5.6×10-12 | 7.4×10-11 | 4 .0×10-38 | 1.8×10-10 | 2.2×10-20 | 2.0×10-12 |
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秋冬季我国北方大部分地区出现严重雾霾天气,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,城市雾霾中还含有铜等重金属元素。
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、![]() 等二次污染物。
等二次污染物。
①基态N原子的电子排布式___________;C、N和O的第一电离能由大到小的顺序为___________
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是________,写出一种与氨硼烷互为等电子体的分子________(填化学式)。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间存在的作用力有________(填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力
②NH4NO3中阴离子的空间构型为________,阳离子的中心原子轨道采用________杂化。

(3)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为____________,晶体中每个镁原子周围距离最近的铝原子数目为___________,该晶体的密度为__________________g/cm3(阿伏伽德罗常数的数值用NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com