
【题目】肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:①N2(g)+2O2(g)=N2O4(g)ΔH=+8.7kJ·mol-1;②N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-534.0kJ·mol-1;下列表示肼跟N2O4反应的热化学方程式正确的是
A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-542.7kJ·mol-1
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1059.3kJ·mol-1
C.N2H4(g)+![]() N2O4(g)=
N2O4(g)=![]() N2(g)+2H2O(g)ΔH=-1076.7kJ·mol-1
N2(g)+2H2O(g)ΔH=-1076.7kJ·mol-1
D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1076.7kJ·mol-1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是

A.Y、Z、W三种元素电负性:W>Z>Y
B.Y、Z、W三种元素第一电离能:Z>W>Y
C.L的沸点一定比X、Y组成的化合物沸点高
D.由X、Y、Z、W构成的化合物中可能只含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中不正确的是

A. 该生产工艺中Br2被循环利用
B. 在电解过程中,电解槽阴极附近溶液的pH变大
C. 原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+
D. 该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
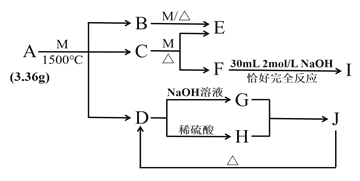
【题目】物质A由三种元素组成。M是单质,空气的主要成分之一。B是一种固体单质,组成该物质的元素在A中的质量分数约为![]() 。C、D均由两种元素组成,C中两元素同主族。I是一种建筑用的黏合剂。各物质之间的转化关系如图:
。C、D均由两种元素组成,C中两元素同主族。I是一种建筑用的黏合剂。各物质之间的转化关系如图:
请回答:
![]() 中所含元素是_____________
中所含元素是_____________![]() 填元素名称
填元素名称![]() 。
。
![]() 与M反应的化学方程式为_______________________________________。
与M反应的化学方程式为_______________________________________。
![]() 写出
写出![]() 的离子方程式___________________________________________。
的离子方程式___________________________________________。
![]() 请设计实验方案证明E可能的成分___________________________________________。
请设计实验方案证明E可能的成分___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
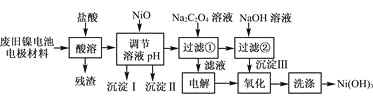
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
|
| 开始沉淀pH | 沉淀完全pH |
|
|
|
|
|
|
|
|
|
|
|
|
回答下列问题:
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ__________(填化学式)。
(2) 写出加入Na2C2O4溶液的反应的化学方程式:_____________________。
(3) 检验电解滤液时阳极产生的气体的方法:___________________________。
(4) 写出“氧化”反应的离子方程式:___________________________________。
(5) 如何检验Ni(OH)3已洗涤干净?_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的甲、乙、丙、丁代表化学中常见的四种物质,其中甲、乙、丙均含有同一种元素。相互转化的关系如下,请回答下列问题。
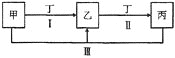
(1)甲气体的水溶液能使酚酞变红,乙为空气中含量最大的气体,写出反应![]() Ⅲ
Ⅲ![]() 的化学方程式:________________________________。
的化学方程式:________________________________。
(2)常温下![]() 的丁溶液pH为13,其焰色反应为黄色。甲、乙、丙为均含有同一种金属元素的无机化合物,反应
的丁溶液pH为13,其焰色反应为黄色。甲、乙、丙为均含有同一种金属元素的无机化合物,反应![]() Ⅲ
Ⅲ![]() 的离子方程式为___________________________________。
的离子方程式为___________________________________。
(3)若乙为淡黄色非金属单质,则反应![]() Ⅲ
Ⅲ![]() 中氧化产物与还原产物的物质的量之比为______________,
中氧化产物与还原产物的物质的量之比为______________,![]() 甲与含
甲与含![]() 的溶液充分反应后溶液呈碱性,溶液中所含乙元素的相关离子浓度的大小关系为________________。
的溶液充分反应后溶液呈碱性,溶液中所含乙元素的相关离子浓度的大小关系为________________。
(4)若甲、乙、丙的溶液均显碱性,丁为温室效应主要气体。浓度相同的乙、丙溶液pH较大的是______________![]() 填溶质的化学式
填溶质的化学式![]() 溶液,原因是______________________________。
溶液,原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学镀是指使用合适的还原剂,使镀液中的金属离子还原成金属而沉积在镀件表面上的一种镀覆工艺。化学镀广泛用作金属、塑料、玻璃、陶瓷等许多材料的装饰和防护。在ABS工程塑料表面进行化学镀镍的流程如下:
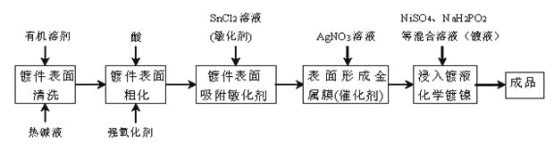
回答下列问题:
(1)化学镀与电镀比较,优点之一是_________。
(2)镀件表面用热碱液清洗的作用是_________,镀件表面粗化的目的是增强亲水性及_________。
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是_________。
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是_________。
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如下表所示:

由此推断,镀层厚度y与反应时间t的关系式为_________;欲使镀层厚度为6anm,需要的反应时间为_________。
(6)化学镀镍废液中含有Ni2+等污染物,需转化为沉淀除去。已知25℃,Ksp[Ni(OH)2]=2.0×10-15。若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为_________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)![]() 3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的百分含量与时间的关系如图2所示。则下列结论正确的是( )
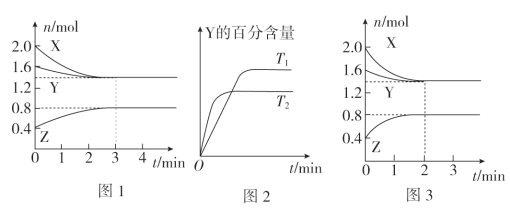
A.容器中发生的反应可表示为3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com