
【题目】物质A由三种元素组成。M是单质,空气的主要成分之一。B是一种固体单质,组成该物质的元素在A中的质量分数约为![]() 。C、D均由两种元素组成,C中两元素同主族。I是一种建筑用的黏合剂。各物质之间的转化关系如图:
。C、D均由两种元素组成,C中两元素同主族。I是一种建筑用的黏合剂。各物质之间的转化关系如图:
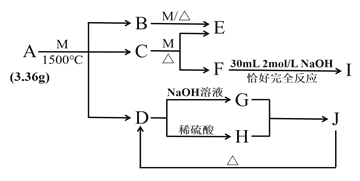
请回答:
![]() 中所含元素是_____________
中所含元素是_____________![]() 填元素名称
填元素名称![]() 。
。
![]() 与M反应的化学方程式为_______________________________________。
与M反应的化学方程式为_______________________________________。
![]() 写出
写出![]() 的离子方程式___________________________________________。
的离子方程式___________________________________________。
![]() 请设计实验方案证明E可能的成分___________________________________________。
请设计实验方案证明E可能的成分___________________________________________。
【答案】铝、硅、碳 ![]()
![]()
![]()
![]() 成分可能是:只有CO;只有
成分可能是:只有CO;只有![]() ;CO和
;CO和![]() 混合物;检验方法:将气体依次通过①澄清石灰水②足量氢氧化钠溶液③澄清石灰水④浓硫酸⑤灼热的氧化铜⑥澄清石灰水⑦燃着的酒精灯或气囊,若只有①变浑浊,则只有
混合物;检验方法:将气体依次通过①澄清石灰水②足量氢氧化钠溶液③澄清石灰水④浓硫酸⑤灼热的氧化铜⑥澄清石灰水⑦燃着的酒精灯或气囊,若只有①变浑浊,则只有![]() ;若①无明显现象,⑤黑色变红色⑥变浑浊,则只有CO;若①变浑浊③无明显现象⑤黑色变红色⑥变浑浊,则E为CO和
;若①无明显现象,⑤黑色变红色⑥变浑浊,则只有CO;若①变浑浊③无明显现象⑤黑色变红色⑥变浑浊,则E为CO和![]() 混合物
混合物
【解析】
C、D均由两种元素组成,由D与酸碱反应知D为氧化铝,G为偏铝酸钠,H为硫酸铝,J为氢氧化铝, M是单质,空气的主要成分之一,是氧气,氮气的化学性质较稳定,排除。F能与30mL,2mol/L氢氧化钠反应,I是一种建筑用的黏合剂,为硅酸钠,F为二氧化硅,C为碳化硅;各种物质的质量可求出A的组成,根据A的性质回答下列问题。E为碳与氧气反应的物质,完全燃烧,不完全燃烧产物不同。
(1)C、D均由两种元素组成,由D与酸碱反应知D为氧化铝,G为偏铝酸钠,H为硫酸铝,J为氢氧化铝, M是单质,空气的主要成分之一,是氧气,氮气的化学性质较稳定,排除。F能与30mL,2mol/L氢氧化钠反应,I是一种建筑用的黏合剂,为硅酸钠,F为二氧化硅,C为碳化硅,根据二氧化硅与氢氧化钠反应的离子方程式可知,![]() ,二氧化硅的物质的量n=
,二氧化硅的物质的量n=![]() =0.03mol,根据硅元素守恒,碳化硅的物质的量也为0.03mol,硅元素的物质的量也为0.03mol,则碳化硅的质量为0.03 mol×40g/mol=1.2g,B是一种固体单质是碳,C中两元素同主族是碳化硅,故A中所含元素是铝、硅、碳 ,B是一种固体单质是碳,组成该物质的元素在A中的质量分数约为
=0.03mol,根据硅元素守恒,碳化硅的物质的量也为0.03mol,硅元素的物质的量也为0.03mol,则碳化硅的质量为0.03 mol×40g/mol=1.2g,B是一种固体单质是碳,C中两元素同主族是碳化硅,故A中所含元素是铝、硅、碳 ,B是一种固体单质是碳,组成该物质的元素在A中的质量分数约为![]() ,A的质量为3.36g,则A中碳元素的质量为3.36g×
,A的质量为3.36g,则A中碳元素的质量为3.36g×![]() =0.9g,碳元素的物质的量为
=0.9g,碳元素的物质的量为![]() =0.075mol,硅元素的质量为0.03 mol×40g/mol×
=0.075mol,硅元素的质量为0.03 mol×40g/mol×![]() =0.84g ,则铝元素的质量为3.36g-0.9g-0.84g=1.62g,n=
=0.84g ,则铝元素的质量为3.36g-0.9g-0.84g=1.62g,n=![]() =0.06mol,故铝,硅,碳元素的物质的量之比等于0.06:0.03:0.075=4:2:5,故A的化学式为
=0.06mol,故铝,硅,碳元素的物质的量之比等于0.06:0.03:0.075=4:2:5,故A的化学式为![]() ,故A中所含元素是铝、硅、碳 ;
,故A中所含元素是铝、硅、碳 ;
(2)![]() 与M反应的化学方程式为:
与M反应的化学方程式为:![]()
![]()
![]() ;
;
(3)![]() 为二氧化硅与氢氧化钠溶液反应,离子方程式为:
为二氧化硅与氢氧化钠溶液反应,离子方程式为:![]() ;
;
(4)成分可能是:只有CO;只有![]() ;CO和
;CO和![]() 混合物。检验方法:将气体依次通过①澄清石灰水②足量氢氧化钠溶液③澄清石灰水④浓硫酸⑤灼热的氧化铜⑥澄清石灰水⑦燃着的酒精灯或气囊,若只有①变浑浊,则只有
混合物。检验方法:将气体依次通过①澄清石灰水②足量氢氧化钠溶液③澄清石灰水④浓硫酸⑤灼热的氧化铜⑥澄清石灰水⑦燃着的酒精灯或气囊,若只有①变浑浊,则只有![]() ;若①无明显现象,⑤黑色变红色⑥变浑浊,则只有CO;若①变浑浊③无明显现象⑤黑色变红色⑥变浑浊,则E为CO和
;若①无明显现象,⑤黑色变红色⑥变浑浊,则只有CO;若①变浑浊③无明显现象⑤黑色变红色⑥变浑浊,则E为CO和![]() 混合物。
混合物。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 电解法精炼铜时,以粗铜作阴极,纯铜作阳极
B. 反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
C. CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
D. Na2CO3溶液中加入少量Ca(OH)2固体,CO![]() 水解程度减小,溶液的pH减小
水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国谚语与古籍中,有许多关于化学变化的记载。例如,谚语“雷雨发庄稼”;《淮南万毕术》中记载“曾青得铁则化为铜”,以上例子不涉及的反应是( )
A.N2+O2![]() 2NOB.Zn+Fe2+=Zn2++Fe
2NOB.Zn+Fe2+=Zn2++Fe
C.Fe+Cu2+=Fe2++CuD.3NO2+H2O=2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂亚硫酰氯(Li/SOCl2)电池是实际应用电池系列中比能量最高的一种电池,剖视图如图所示,一种非水的LiAlCl4的SOCl2溶液为电解液。亚硫酸氯既是电解质,又是正极活性物质,其中碳电极区的电极反应式为2SOCl2+4e-=4Cl-+S+SO2↑,该电池工作时,下列说法错误的是( )

A. 锂电极区发生的电极反应:Li-e-=Li+
B. 放电时发生的总反应:4Li+2SOCl2=4LiCl+SO2↑+S
C. 锂电极上的电势比碳电极上的低
D. 若采用水溶液代替SOCl2溶液,电池总反应和效率均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
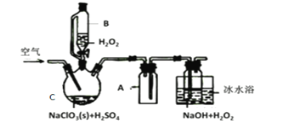
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
(1)冰水浴冷却的目的是___。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,__。
(3)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①___(用离子方程式表示)②H2O2+Cl2=2Cl-+O2+2H+
(4)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为___。(M(NaClO2)=90.5g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H =-a kJ·mol-1 (a > 0),其反应机理如下:①NO(g)+Br2(g)
2NOBr(g) △H =-a kJ·mol-1 (a > 0),其反应机理如下:①NO(g)+Br2(g)![]() NOBr2 (g)快②NO(g)+NOBr2(g)
NOBr2 (g)快②NO(g)+NOBr2(g)![]() 2NOBr(g)慢,下列有关该反应的说法正确的是 ( )
2NOBr(g)慢,下列有关该反应的说法正确的是 ( )
A.该反应的速率主要取决于①的快慢
B.NOBr2是该反应的催化剂
C.正反应的活化能比逆反应的活化能小a kJ·mol-1
D.增大Br2 (g)浓度能增大单位体积内活化分子百分数,加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:①N2(g)+2O2(g)=N2O4(g)ΔH=+8.7kJ·mol-1;②N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-534.0kJ·mol-1;下列表示肼跟N2O4反应的热化学方程式正确的是
A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-542.7kJ·mol-1
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1059.3kJ·mol-1
C.N2H4(g)+![]() N2O4(g)=
N2O4(g)=![]() N2(g)+2H2O(g)ΔH=-1076.7kJ·mol-1
N2(g)+2H2O(g)ΔH=-1076.7kJ·mol-1
D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1076.7kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝钠![]() 是有机合成中的重要还原剂,其合成路线如图所示。
是有机合成中的重要还原剂,其合成路线如图所示。
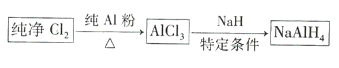
某实验小组利用如图所示的装置制备无水![]() 。
。
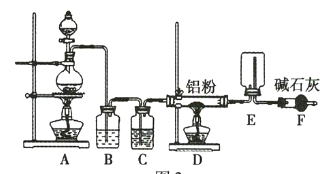
(1)装置F的作用是 _____________________________ 。
(2)![]() 与NaH反应时,需将
与NaH反应时,需将![]() 溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
(3)利用氢化铝钠遇水反应生成的氢气的体积测定氢化铝钠样品的纯度。
①其反应的化学方程式为 _____________________________
②设计如图四种装置测定氢化铝钠样品的纯度(假设杂质不参与反应)。
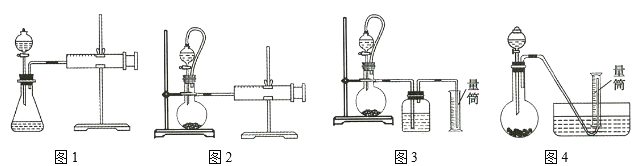
从简约性、准确性角度考虑,最适宜的装置是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是

A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com