
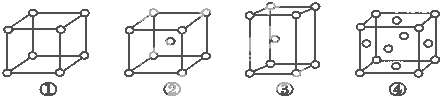
| A、①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积 |
| B、每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个 |
| C、晶胞中原子的配位数分别为:①6,②8,③8,④12 |
| D、空间利用率的大小关系为:①<②<③<④ |
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
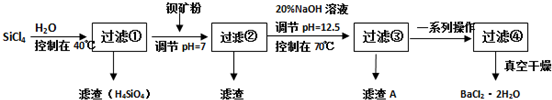
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②①③⑤④ |
| B、⑤③②①⑤④ |
| C、⑤②③①④⑤ |
| D、③⑤②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
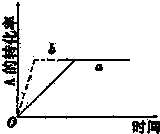
| A、增大A的浓度 |
| B、缩小容器的体积 |
| C、加入催化剂 |
| D、升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度能加快生成尿素的速率 |
| B、增大压强能使反应有利于向生物方向移动 |
| C、氨碳比越大越有利于尿素的生成 |
| D、若氨能与反应生成的水结合生成一水合氨,则能促使平衡向生成尿素方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.250 mol |
| B、0.125 mol |
| C、0.100 mol |
| D、0.080 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl发生了氧化反应 |
| B、可用于海上照明供电 |
| C、若将镁换成铝,也可构成海水原电池 |
| D、电子由镁电极流出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com