
| 2.2×10-38 |
| (10-7)3 |


科目:高中化学 来源: 题型:
| A、Na+、K+、HCO3-、NO3- |
| B、Ba2+、Mg2+、SO42-、Cl- |
| C、Ag+、K+、Na+、NO3- |
| D、K+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
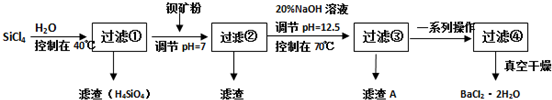
 运用化学反应原理研究氮及其化合物的反应有重要意义.
运用化学反应原理研究氮及其化合物的反应有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1H、D+、T2互为同位素 |
| B、H2O、CH3COOH、NH4HCO3都是电解质 |
| C、铝、铁、铜三者对应的氧化物均为碱性氧化物 |
| D、有单质参加的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
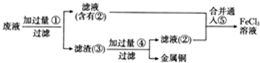 电子工业常用30%的FeCl3 溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板.
电子工业常用30%的FeCl3 溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板.查看答案和解析>>
科目:高中化学 来源: 题型:
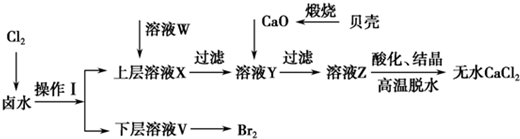
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
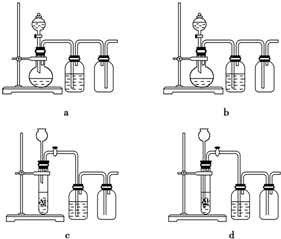
查看答案和解析>>
科目:高中化学 来源: 题型:
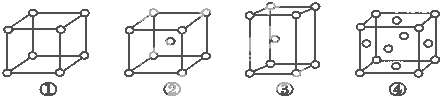
| A、①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积 |
| B、每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个 |
| C、晶胞中原子的配位数分别为:①6,②8,③8,④12 |
| D、空间利用率的大小关系为:①<②<③<④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com