
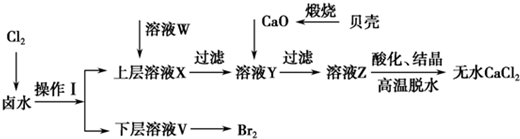
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |


科目:高中化学 来源: 题型:
| A、只有① | B、只有①③⑤ |
| C、只有①②③ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
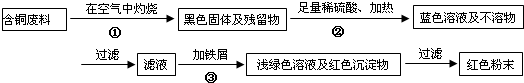
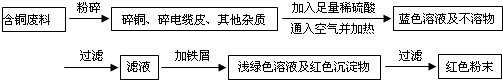
| 序号 | 实验操作 | 实验现象 | 结论及离子方程式 |
| ① | 取适量的样品于试管内 | -- | -- |
| ② | 用滴管滴入足量硫酸溶液,并充分振荡试管 | ||
| ③ | 溶液先黄色,滴入KSCN溶液后显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
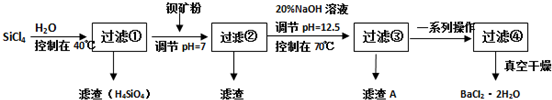
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
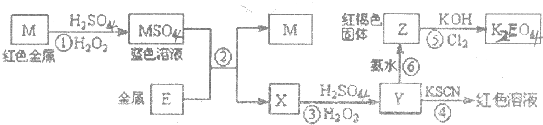
| A、M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱 |
| B、反应①、②、③、④、⑤都属于氧化还原反应,且在反应①和③中硫酸都是既表现了酸性、又表现了氧化性 |
| C、用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:EO42-+4H2O+3e-═E(OH)3+5OH- |
| D、反应④、⑥的离子方程式分别可表示为E3++3SCN-=E(SCN)3,3NH3﹒H2O+E3+═E(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②①③⑤④ |
| B、⑤③②①⑤④ |
| C、⑤②③①④⑤ |
| D、③⑤②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com