



 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| A、该反应中NH4NO3只作氧化剂 |
| B、ZnO是还原产物 |
| C、水在反应中可能起催化作用 |
| D、每生成1mol N2共转移8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
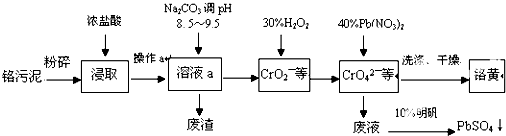
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1H、D+、T2互为同位素 |
| B、H2O、CH3COOH、NH4HCO3都是电解质 |
| C、铝、铁、铜三者对应的氧化物均为碱性氧化物 |
| D、有单质参加的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
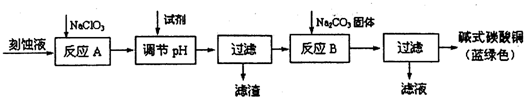
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1,4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
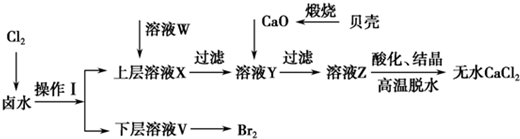
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
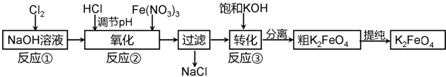
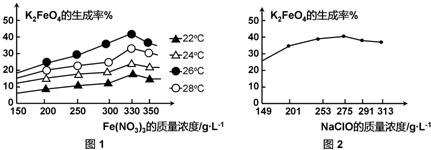
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质溶液里加(NH4)2SO4溶液可提纯蛋白质 |
| B、在豆浆中加入少量石膏能使豆浆凝结为豆腐 |
| C、温度越高,酶对某些化学反应的催化效率越高 |
| D、鉴别某纺织物成分是蛋白丝还是人造丝,可采用灼烧闻气味的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com