
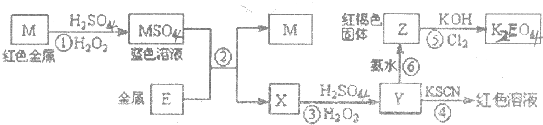
| A、M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱 |
| B、反应①、②、③、④、⑤都属于氧化还原反应,且在反应①和③中硫酸都是既表现了酸性、又表现了氧化性 |
| C、用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:EO42-+4H2O+3e-═E(OH)3+5OH- |
| D、反应④、⑥的离子方程式分别可表示为E3++3SCN-=E(SCN)3,3NH3﹒H2O+E3+═E(OH)3↓+3NH4+ |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
| A、Na2O2与CO2反应中,Na2O2只作还原剂,CO2作氧化剂 |
| B、Na2O2与H2O反应中,Na2O2既作氧化剂又做还原剂 |
| C、Na2O2与CO2反应中,1mol Na2O2转移2mol电子 |
| D、Na2O2与水反应中,1mol Na2O2转移1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
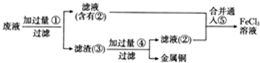 电子工业常用30%的FeCl3 溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板.
电子工业常用30%的FeCl3 溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板.查看答案和解析>>
科目:高中化学 来源: 题型:
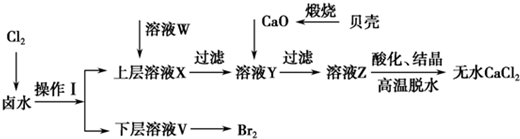
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
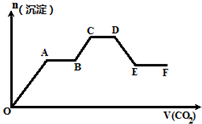
| A、O~A段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O |
| B、A~B段反应的离子方程式是2OH-+CO2═CO32-+H2O |
| C、A~B段与C~D段所发生的反应相同 |
| D、D~E段沉淀的减少是由于碳酸钡固体的溶解所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入新制的氯水振荡,再加入少量CCl4振荡,观察下层是否变为橙红色 |
| B、加入硝酸银溶液,再加入稀硝酸使溶液呈酸性,观察有无浅黄色沉淀生成 |
| C、加入NaOH溶液共热,冷却后加入硝酸银溶液,观察有无浅黄色沉淀生成 |
| D、加入NaOH溶液共热,冷却后加入稀硝酸使溶液呈酸性,再滴入硝酸银溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com