
| A、石墨 |
| B、CO2 |
| C、BaSO4 |
| D、Fe |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
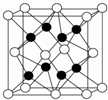 A、X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;A原子价电子排布式nsnnpn+1,X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):
A、X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;A原子价电子排布式nsnnpn+1,X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
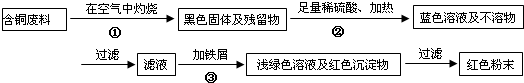
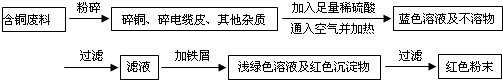
| 序号 | 实验操作 | 实验现象 | 结论及离子方程式 |
| ① | 取适量的样品于试管内 | -- | -- |
| ② | 用滴管滴入足量硫酸溶液,并充分振荡试管 | ||
| ③ | 溶液先黄色,滴入KSCN溶液后显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
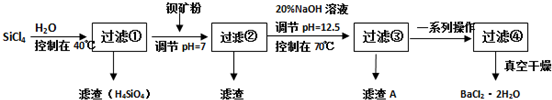
查看答案和解析>>
科目:高中化学 来源: 题型:
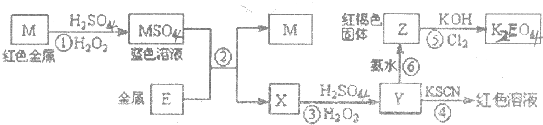
| A、M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱 |
| B、反应①、②、③、④、⑤都属于氧化还原反应,且在反应①和③中硫酸都是既表现了酸性、又表现了氧化性 |
| C、用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:EO42-+4H2O+3e-═E(OH)3+5OH- |
| D、反应④、⑥的离子方程式分别可表示为E3++3SCN-=E(SCN)3,3NH3﹒H2O+E3+═E(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
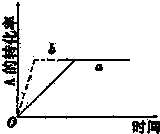
| A、增大A的浓度 |
| B、缩小容器的体积 |
| C、加入催化剂 |
| D、升高温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com