
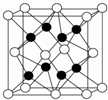
 A、X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;A原子价电子排布式nsnnpn+1,X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):
A、X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;A原子价电子排布式nsnnpn+1,X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):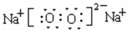 ,其晶体是离子晶体,根据均摊法可知,在晶胞中含有Na+数为8,O2-数为8×
,其晶体是离子晶体,根据均摊法可知,在晶胞中含有Na+数为8,O2-数为8×| 1 |
| 8 |
| 1 |
| 2 |
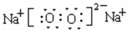 ;离子;Na2O;
;离子;Na2O;| 7+1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
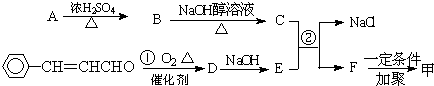
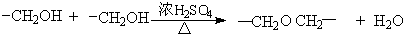
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| X溶液 | MgCl2溶液 | MgCl2溶液 | AlCl3溶液 | AlCl3溶液 |
| Y溶液 | NaOH溶液 | 氨水 | NaOH溶液 | 氨水 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

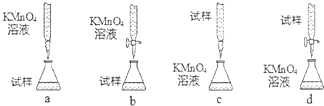
查看答案和解析>>
科目:高中化学 来源: 题型:
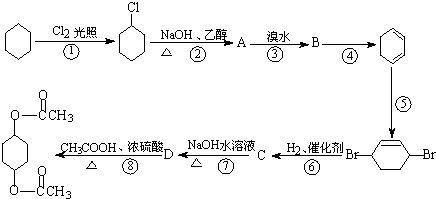
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、HCO3-、NO3- |
| B、Ba2+、Mg2+、SO42-、Cl- |
| C、Ag+、K+、Na+、NO3- |
| D、K+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2与CO2反应中,Na2O2只作还原剂,CO2作氧化剂 |
| B、Na2O2与H2O反应中,Na2O2既作氧化剂又做还原剂 |
| C、Na2O2与CO2反应中,1mol Na2O2转移2mol电子 |
| D、Na2O2与水反应中,1mol Na2O2转移1mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com