


科目:高中化学 来源: 题型:
| A | B | C | D | |
| X溶液 | MgCl2溶液 | MgCl2溶液 | AlCl3溶液 | AlCl3溶液 |
| Y溶液 | NaOH溶液 | 氨水 | NaOH溶液 | 氨水 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2与CO2反应中,Na2O2只作还原剂,CO2作氧化剂 |
| B、Na2O2与H2O反应中,Na2O2既作氧化剂又做还原剂 |
| C、Na2O2与CO2反应中,1mol Na2O2转移2mol电子 |
| D、Na2O2与水反应中,1mol Na2O2转移1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
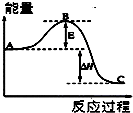 运用化学反应原理研究氮及其化合物的反应有重要意义.
运用化学反应原理研究氮及其化合物的反应有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
. |
| M |
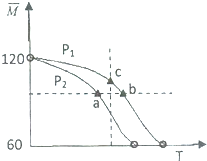
. |
| M |
查看答案和解析>>
科目:高中化学 来源: 题型:
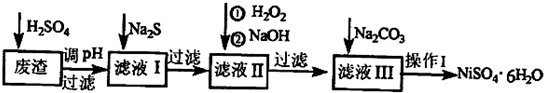
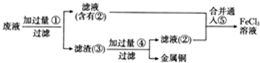 电子工业常用30%的FeCl3 溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板.
电子工业常用30%的FeCl3 溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入新制的氯水振荡,再加入少量CCl4振荡,观察下层是否变为橙红色 |
| B、加入硝酸银溶液,再加入稀硝酸使溶液呈酸性,观察有无浅黄色沉淀生成 |
| C、加入NaOH溶液共热,冷却后加入硝酸银溶液,观察有无浅黄色沉淀生成 |
| D、加入NaOH溶液共热,冷却后加入稀硝酸使溶液呈酸性,再滴入硝酸银溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com