
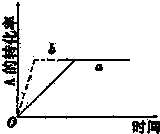
| A、增大A的浓度 |
| B、缩小容器的体积 |
| C、加入催化剂 |
| D、升高温度 |
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
| A、加入新制的氯水振荡,再加入少量CCl4振荡,观察下层是否变为橙红色 |
| B、加入硝酸银溶液,再加入稀硝酸使溶液呈酸性,观察有无浅黄色沉淀生成 |
| C、加入NaOH溶液共热,冷却后加入硝酸银溶液,观察有无浅黄色沉淀生成 |
| D、加入NaOH溶液共热,冷却后加入稀硝酸使溶液呈酸性,再滴入硝酸银溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两途径最终达到平衡时,体系内混合气体各组分百分组成相同 |
| B、两途径最终达到平衡时,体系内混合气体各组分百分组成不同 |
| C、达到平衡时,途径I的反应速率等于途径Ⅱ的反应速率 |
| D、达到平衡时,途径I所得混合气的密度等于途径Ⅱ所得混合气密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O. ④HCHO等,
④HCHO等,查看答案和解析>>
科目:高中化学 来源: 题型:
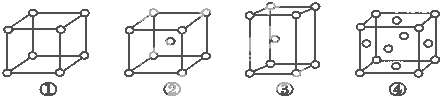
| A、①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积 |
| B、每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个 |
| C、晶胞中原子的配位数分别为:①6,②8,③8,④12 |
| D、空间利用率的大小关系为:①<②<③<④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车尾气中含有NOx,NOx是引起温室效应的主要气体之一 |
| B、N2中π键与σ键之比为1:2 |
| C、反应③中每生成标况下的22.4 L N2转移电子数1.5NA |
| D、NH3的沸点比PH3的沸点高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com