
 含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O. ④HCHO等,
④HCHO等,| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
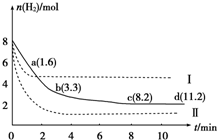 固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,某科学实验将6mol CO2和8mol H2充入一容积为2L的密闭容器中,测得H2的物质的量随时间变化如图中实线所示(图中字母后数字表示对应的坐标):下列说法不正确的是( )
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,某科学实验将6mol CO2和8mol H2充入一容积为2L的密闭容器中,测得H2的物质的量随时间变化如图中实线所示(图中字母后数字表示对应的坐标):下列说法不正确的是( )| A、该反应在低温条件下能自发进行 |
| B、曲线Ⅰ改变的条件可能是升高温度 |
| C、若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是:K2>K>K1 |
| D、容器内气体平均摩尔质量不再改变说明该反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
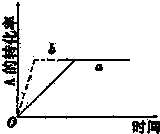
| A、增大A的浓度 |
| B、缩小容器的体积 |
| C、加入催化剂 |
| D、升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用10 mL 量筒量取5.2 mL盐酸 |
| B、用广泛pH试纸测得某溶液的pH值为12.5 |
| C、用托盘天平称取25.12gNaCl固体 |
| D、用100 mL容量瓶配制50mL0.1 mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.250 mol |
| B、0.125 mol |
| C、0.100 mol |
| D、0.080 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
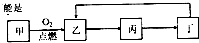 甲~丁是含同一种元素的四种物质,甲和丁分别是该元素的单质和最高价氧化物的水化物,它们之间有如图所示的转化关系,甲不可能是( )
甲~丁是含同一种元素的四种物质,甲和丁分别是该元素的单质和最高价氧化物的水化物,它们之间有如图所示的转化关系,甲不可能是( )| A、Fe | B、Si | C、Al | D、S |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com