
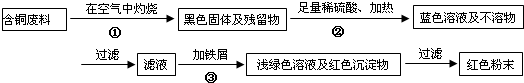
| ��� | ʵ����� | ʵ������ | ���ۼ����ӷ���ʽ |
| �� | ȡ��������Ʒ���Թ��� | -- | -- |
| �� | �õιܵ�������������Һ����������Թ� | ||
| �� | ��Һ�Ȼ�ɫ������KSCN��Һ���Ժ�ɫ |
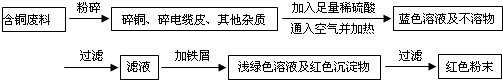
| ��� | ʵ����� | ʵ������ | ���� |
| �� | -- | -- | |
| �� | ��Ʒ�����ܽ⣬�������ݷų� | ��Ʒ����������м Fe+2H+=Fe2++H2�� | |
| �� | ���Թܾ�ֹ�����ϲ���Һ�㵹����һ�Թ��У��ȵ�������������Һ���ٵ��뼸��KSCN��Һ | Fe2+������������Fe3+����SCN-����Ѫ��ɫ |
| ||



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
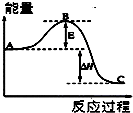 ���û�ѧ��Ӧԭ���о������仯����ķ�Ӧ����Ҫ���壮
���û�ѧ��Ӧԭ���о������仯����ķ�Ӧ����Ҫ���壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
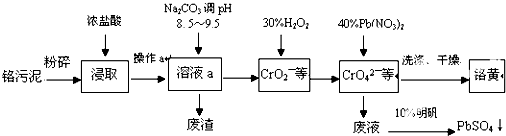
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1H��D+��T2��Ϊͬλ�� |
| B��H2O��CH3COOH��NH4HCO3���ǵ���� |
| C����������ͭ���߶�Ӧ���������Ϊ���������� |
| D���е��ʲμӵķ�Ӧһ����������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
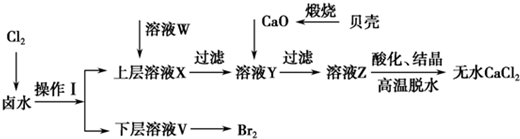
| ��ʼ����ʱ��pH | ������ȫʱ��pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c��OH-��=1.8mol?L-1 |
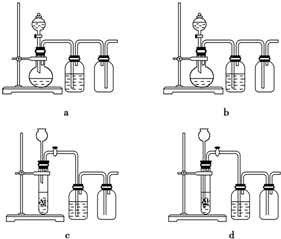
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����;�����մﵽƽ��ʱ����ϵ�ڻ���������ְٷ������ͬ |
| B����;�����մﵽƽ��ʱ����ϵ�ڻ���������ְٷ���ɲ�ͬ |
| C���ﵽƽ��ʱ��;��I�ķ�Ӧ���ʵ���;����ķ�Ӧ���� |
| D���ﵽƽ��ʱ��;��I���û�������ܶȵ���;�������û�����ܶ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com